Улогата на протеините во човечкото тело

Големата важност на протеините за организмот се должи на нивните функции.
Презентираните основни функции на протеините ја илустрираат важноста на оваа класа на супстанции во обезбедувањето на нормален живот на човекот.
Во 19 век, научниците изјавиле:
- протеинските тела се уникатни, суштината на животот,
- потребен е постојан метаболизам помеѓу живите суштества и околината.
Овие одредби остануваат непроменети до сега.
Основен состав на протеини
Огромните молекуларни единици на едноставен протеин наречен протеин се формираат од хемиски поврзани мали блокови - аминокиселини со идентични и различни фрагменти. Ваквите структурни композиции се нарекуваат хетерополимери. Само 20 претставници од класата на аминокиселини секогаш се наоѓаат во природни протеини. Основниот состав на протеините се карактеризира со задолжително присуство на јаглерод - Ц, азот - Н, водород - Н, кислород - О. Сулфур - С. Често се наоѓа во сулфур протеините наречени протеиди, други супстанции се содржат во прилог на остатоци од аминокиселини. Според тоа, фосфор - П, бакар - Cu, железо - Fe, јод - I, селен - Se може да биде во нивниот состав.
Аминокарбоксилните киселини на природните протеини се класифицирани според хемиската структура и биолошката важност. Хемиската класификација е важна за хемичарите, биолошката - за секого.
Во човечкото тело секогаш има два струја на трансформации:
- дефект, оксидација, отстранување на прехранбени производи,
- биолошка синтеза на нови основни супстанции.
12 аминокиселини од секогаш пронајдени во природни протеини можат да се создадат со биолошка синтеза на човечкото тело. Тие се нарекуваат заменливи.
8 аминокиселини никогаш не се синтетизираат кај луѓето. Тие се неопходни, треба редовно да се даваат со храна.
Според присуството на есенцијални амино-карбоксилни киселини, протеините се поделени во две класи.
- Комплетни протеини ги имаат сите аминокиселини потребни од човечкото тело. Потребниот сет на есенцијални аминокиселини содржи протеини од урда, млечни производи, живина, месо говеда, морска и слатководна риба, јајца.
- Кај неисправни протеини, може да недостасуваат една или повеќе важни киселини. Овие вклучуваат растителни протеини.
За да се процени квалитетот на протеините во исхраната, медицинската светска заедница ги споредува со „идеален“ протеин, кој има строго проверени пропорции на есенцијални и основни есенцијални аминокиселини. Во природата, „идеален“ протеин не постои. Колку е близу до него како животински протеини. Растителните протеини честопати не се доволни за нормативната концентрација на една или повеќе аминокиселини. Ако се додаде супстанцијата што недостасува, протеинот ќе стане целосен.
Главните извори на протеини од растително и животинско потекло
Во домашната научна заедница ангажирана во сеопфатна студија за хемија на храна, се издвојува група професори А.П. Нечаев, неговите колеги и студенти. Тимот ја утврди содржината на протеини во главните прехранбени производи достапни на рускиот пазар.
- Важно! Идентификуваните бројки информираат за содржината на протеини во 100 g од производот, ослободена од јадениот дел.
- Најголемо количество протеини се наоѓа во соја, семки од тиква и кикиритки (34,9 - 26,3 g).
- Вредности од 20 до 30 грама се наоѓаат во грашок, грав, фстаци и семки од сончоглед.
- Бадеми, кашули, лешници се карактеризираат со броеви од 15 до 20 гр.
- Оревите, тестенините, повеќето житарки (освен ориз, пченкасти житки) содржат од 10 до 15 грама протеини на 100 грама производ.
- Ориз, пченкасти рисови, леб, лук, суви кајсии спаѓаат во опсег од 5 до 10 гр.
- Во 100 грама зелка, печурки, компири, сливи, некои сорти на репка, содржината на протеини е од 2 до 5 грама.
- Суво грозје, ротквици, моркови, слатки пиперки имаат малку протеини, нивните показатели не надминуваат 2 грама.
Ако не бевте во состојба да пронајдете растителен предмет, тогаш концентрацијата на протеини во него е премногу мала или воопшто не е таму. На пример, кај овошните сокови има многу малку протеини, во природните растителни масла - воопшто не.
- Максималната концентрација на протеини е пронајдена кај рибино рио, тврдо и преработено сирење и зајачко месо (од 21,1 до 28,9 g).
- Голем број на производи содржат од 15 до 10 грама протеини. Ова е птица, морска риба (освен капелин), говеда месо, ракчиња, лигњи, урда, фета сирење, слатководна риба.
- Капелин, пилешко јајце, свинско месо содржат 12,7 до 15 грама протеини на 100 грама производ.
- Јогурт, урда од сирење се карактеризираат со броеви 5 - 7,1 гр.
- Млекото, кефирот, ферментираното печено млеко, павлаката, павлаката содржат од 2,8 до 3 грама протеини.
Информациите за главните извори на протеини од растително и животинско потекло за производи што биле подложени во повеќестепена технолошка обработка (чорба, колбаси, шунка, колбаси) не се интересни. Не се препорачуваат за редовно здраво јадење. Краткорочната употреба на такви производи не е значајна.
Улогата на протеините во исхраната
Како резултат на метаболички процеси во организмот, постојано се формираат нови протеински молекули, наместо старите. Стапката на синтеза во различни органи не е иста. Хормонските протеини, на пример, инсулинот, се обновуваат (ресинтетизираат) многу брзо, за неколку часа, минути. Протеините на црниот дроб, цревната слузница се регенерираат за 10 дена. Протеинските молекули на мозокот, мускулите, сврзното ткиво се обновени најдолго, ресторативната синтеза (ресинтеза) може да трае и до шест месеци.
Процесот на користење и синтеза се карактеризира со азотна рамнотежа.
- Кај формирана личност со полно здравје, азотниот баланс е нула. Во овој случај, вкупната маса на азот обезбеден со протеини за време на исхраната е еднаква на масата излачена со производи за распаѓање.
- Младите организми се развиваат брзо. Билансот на азот е позитивен. Има многу протеини, помалку се излачува.
- Во стареењето, болните луѓе, азотниот баланс е негативен. Масата на азот ослободен со метаболички производи е поголема од онаа примена со внес на храна.
Улогата на протеините во исхраната е да му обезбеди на лицето потребна количина на аминокиселински компоненти погодни за учество во биохемиските процеси на организмот.
За да се обезбеди нормален метаболизам, важно е да знаете колку протеини треба да консумира едно лице на ден.
Домашните и американските физиолози препорачуваат јадење 0,8 - 1 g протеини на 1 кг човечка тежина. Бројките се доста во просек. Износот зависи од возраста, природата на работата, начинот на живот на една личност. Во просек, тие препорачуваат да се консумираат од 60 грама до 100 грама протеини на ден. За мажите кои се занимаваат со физичка работа, нормата може да се зголеми на 120 грама на ден. За оние кои се подложени на операција, заразни заболувања, нормата се зголемува и на 140 грама на ден. Дијабетичарите се препорачуваат диети со голема содржина на протеини производи, кои можат да достигнат 140 g на ден. Луѓето со метаболички нарушувања, склоност кон гихт, треба да консумираат значително помалку протеини. Норма за нив е 20 - 40 грама на ден.
За луѓето вклучени во активни спортови кои ја зголемуваат мускулната маса, нормата значително се зголемува, може да достигне 1,6-1,8 грама на 1 кг тежина на спортистот.
- Важно! Препорачливо е обучувачот да го разјасни одговорот на прашањето - колку протеини треба да се консумираат на ден за време на вежбањето. Професионалците имаат информации за трошоците за енергија за сите видови обука, начини за одржување на нормалното функционирање на телото на спортистот.
За спроведување на сите физиолошки функции, важно е не само присуството на есенцијални аминокиселини во протеините, туку и ефикасноста на нивната асимилација. Протеинските молекули имаат различни нивоа на организација, растворливост, степен на пристапност до дигестивните ензими. 96% од млечните протеини, јајцата се распаѓаат ефикасно. Во месото, рибата, 93-95% од протеините безбедно се вари. Исклучок се протеините на кожата и косата. Производите што содржат протеини од зеленчук се варат за 60-80%. Во зеленчукот, 80% од протеините се апсорбираат, во компири - 70%, во леб - 62-86%.
Препорачаниот дел од протеини од животински извори треба да биде 55% од вкупната количина протеинска маса.
- Недостаток на протеини во организмот доведува до значителни метаболички промени. Ваквите патологии се нарекуваат дистрофија, кваширкор. За прв пат, беше откриена повреда кај жителите на дивите племиња во Африка, карактеризирана со негативен баланс на азот, нарушена функција на цревата, атрофија на мускулите, зашеметување. Делумен недостаток на протеини може да се појави со слични симптоми, кои можат да бидат благи за некое време. Особено опасно е недостатокот на протеини во телото на детето. Ваквите нарушувања во исхраната можат да предизвикаат физичка и интелектуална инфериорност на растечката личност.
- Вишокот протеин во организмот го преоптоварува екскреторниот систем. Товарот на бубрезите се зголемува. Со постојни патологии во ткивото на бубрезите, процесот може да се влоши. Многу е лошо ако вишокот на протеини во организмот е придружено со недостаток на други вредни компоненти на храна. Во античко време, во земјите на Азија постоел метод на извршување, во кој на осудениот се хранел само месо. Како резултат, сторителот починал од формирање на гниење производи во цревата, по ова труење.
Разумен пристап за обезбедување на протеини на организмот гарантира ефикасно функционирање на сите животни системи.
Студија историја

Протеинот за прв пат е добиен (во форма на глутен) во 1728 година од италијанецот Јакопо Бартоломео Бекари од пченично брашно. Протеините биле изолирани во посебна класа на биолошки молекули во 18 век, како резултат на работата на францускиот хемичар Антоан де Фуркикс и други научници кои забележале својство на протеините за коагулација (денатурација) под влијание на топлина или киселини. Во тоа време, биле испитувани протеини како албумин („белка од јајце“), фибрин (протеин од крвта) и глутен од пченица.
На почетокот на 19 век, веќе беа добиени некои информации за елементарниот состав на протеините, се знаеше дека аминокиселините се формираат за време на хидролизата на протеините. Некои од овие аминокиселини (на пр. Глицин и леуцин) веќе се карактеризираат. Врз основа на анализата на хемискиот состав на протеините, холандскиот хемичар Герит Мулдер хипотезираше дека скоро сите протеини имаат слична емпириска формула. Во 1836 година, Мулдер го предложи првиот модел на хемиската структура на протеините. Врз основа на теоријата на радикалите, тој по неколку рафинирања дошол до заклучок дека минималната структурна единица на протеинот го има следниот состав: Ц40Н62Н.10О12. Тој оваа единица ја нарече „протеин“ (од грчки. Прото - првиот, примарен) и теоријата - „теорија на протеините“. Самиот термин „протеин“ го предложи шведскиот хемичар Јакоб Берзелиус. Според Мулдер, секој протеин се состои од неколку протеински единици, сулфур и фосфор. На пример, тој предложи да се напише формулата на фибрин како 10PrSP. Мулдер исто така ги проучувал производите за уништување на протеините - аминокиселини и за еден од нив (леуцин) со мал дел од грешка, ја утврдил молекуларната тежина - 131 далтони. Со акумулацијата на нови податоци за протеините, теоријата на протеини почна да се критикува, но, и покрај ова, до крајот на 1850-тите години сè уште се сметаше за универзално признат.
До крајот на 19 век, беа испитувани повеќето аминокиселини што сочинуваат протеини. Кон крајот на 1880-тите. Рускиот научник А. Ја.Данилевски забележа постоење на пептидни групи (CO - NH) во молекулот на протеините. Во 1894 г., германскиот физиолог Албрехт Косел изнесе теорија според која аминокиселините се главните структурни елементи на протеините. На почетокот на 20 век, германскиот хемичар Емил Фишер експериментално докажа дека протеините се состојат од аминокиселински остатоци поврзани со пептидни врски. Тој ја спроведе и првата анализа на аминокиселинските секвенци на протеинот и го објасни феноменот на протеолиза.
Сепак, централната улога на протеините во организмите не беше признаена до 1926 година, кога американскиот хемичар Jamesејмс Самнер (подоцна Нобелова награда за хемија) покажа дека ензимот на уреаза е протеин.
Тешкотијата во изолирањето на чистите протеини го отежнува студирањето. Затоа, првите студии беа спроведени со употреба на оние полипептиди кои лесно може да се прочистат во големи количини, т.е. протеини во крвта, пилешки јајца, разни токсини, како и дигестивни / метаболички ензими излачувани по колење на добиток. Кон крајот на 50-тите години, компанијата Оклопно топло куче копродукции беше во можност да исчисти килограм рибонуклеазис на панкреасот на говеда А, кој стана експериментален предмет за многу студии.
Идејата дека секундарната структура на протеините е резултат на формирање на водородни врски помеѓу остатоци од аминокиселини, ја постави Вилијам Астбери во 1933 година, но Линус Паулинг се смета за првиот научник кој успеал успешно да ја предвиди секундарната структура на протеините. Подоцна, Валтер Каузман, потпирајќи се на работата на Каи Лејнерсром-Ланг, даде значаен придонес во разбирањето на законите за формирање на терцијарната структура на протеините и улогата на хидрофобни интеракции во овој процес. Во доцните 1940-ти и раните 50-ти години на минатиот век, Фредерик Сенгер развил метод за секвенционирање на протеините, со кој ја утврдил аминокиселинската секвенца на два инсулински ланци до 1955 година, покажувајќи дека протеините се линеарни полимери на аминокиселини, а не разгранети (како некои шеќери ) синџири, колоиди или циклоли. Првиот протеин, чијашто аминокиселинска секвенца е основана од советските / руските научници, беше во 1972 година аспартатен аминотрансфераза.
Првите просторни структури на протеини добиени со рефракција на Х-зраци (рентгенска дифракција анализа) станаа познати во доцните 50-ти и раните 1960-ти, а структурите откриени со употреба на нуклеарна магнетна резонанца во 1980-тите. Во 2012 година, Банката за протеини со податоци содржи околу 87,000 протеински структури.
Во 21 век, истражувањето на протеините се пресели на квалитативно ново ниво, кога се изучуваат не само индивидуалните прочистени протеини, туку и истовремената промена на бројот и пост-преводните модификации на голем број протеини на одделни клетки, ткива или цели организми. Оваа област на биохемија се нарекува протеомика. Користејќи ги методите на биоинформатика, стана возможно не само да се обработат податоците од анализата на дифракција на Х-зраци, туку и да се предвиди структурата на протеинот врз основа на неговата низа на аминокиселини. Во моментов, криоелектронската микроскопија на големите протеински комплекси и предвидувањата на просторните структури на протеинските домени со употреба на компјутерски програми се приближуваат кон атомската точност.

Големината на протеините може да се мери во однос на остатоци од аминокиселини или во далтони (молекуларна тежина), но заради релативно големата големина на молекулот, протеинската маса се изразува во изведени единици - килдалтони (kDa). Протеините од квасец, во просек, се состојат од 466 остатоци од аминокиселини и имаат молекуларна тежина од 53 kDa. Најголемиот протеин во моментов познат - титин - е компонента на мускулните саркореми, молекуларната тежина на нејзините различни варијанти (изоформи) варира во опсег од 3000 до 3700 kDa. Титин на солеус мускул (лат. Солеус) на една личност се состои од 38.138 аминокиселини.
Амфотеричност
Протеините имаат својство на амфотеричност, односно во зависност од условите, тие покажуваат и кисели и основни својства. Во протеините, постојат неколку видови на хемиски групи способни за јонизација во воден раствор: остатоци од карбоксилна киселина на страничните ланци на кисели аминокиселини (аспартални и глутамински киселини) и групи кои содржат азот на страничните ланци на основни аминокиселини (првенствено ε-амино група на лизин и остаток на амидин CNH (NH)2) аргинин, во нешто помала мерка - остаток на имидазол хистидин). Секој протеин се карактеризира со изоелектрична точка (pI) - средна киселост (pH), на која вкупното електрично полнење на молекулите на овој протеин е нула и, соодветно, тие не се движат во електричното поле (на пример, со електрофореза). Во изоелектричната точка, хидратацијата и растворливоста на протеинот се минимални. Вредноста на ПИ зависи од односот на киселински и основни остатоци на аминокиселини во протеин: за протеини кои содржат многу кисели остатоци на аминокиселини, изоелектричните точки лежат во киселиот регион (ваквите протеини се нарекуваат кисели), а во протеините што содржат повеќе основни остатоци, тие се во алкалниот регион (основни протеини ) PI вредноста на овој протеин исто така може да варира во зависност од јонската јачина и видот на растворот на тампон во кој се наоѓа, бидејќи неутралните соли влијаат на степенот на јонизација на хемиските групи на протеинот. ПИ на протеинот може да се утврди, на пример, од кривата на титрација или со изоелектрично фокусирање.
Во принцип, ПИ на протеин зависи од функцијата што ја извршува: изоелектричната точка на повеќето протеини во 'рбетниците ткиво се движи од 5,5 до 7,0, но во некои случаи вредностите лежат во екстремни области: на пример, за пепсин, протеолитички ензим на силно кисела гастрична сок ПИ
1, и за солените матици - протеинскиот протеин на млеко од лосос, чија карактеристика е висока содржина на аргинин - ПИ
12. Протеините што се врзуваат со нуклеинските киселини како резултат на електростатско интеракција со фосфатните групи, честопати се главните протеини. Пример за такви протеини се хистони и протамини.
Што се протеини?
Протеините се комплексни органски соединенија со висока молекуларна тежина, кои се состојат од остатоци од аминокиселини, комбинирани на посебен начин. Секој протеин има своја индивидуална секвенца на аминокиселини, своја локација во вселената. Важно е да се разбере дека протеините што влегуваат во телото не се апсорбираат од нив во непроменета форма, тие се распаѓаат во аминокиселини и со нивна помош телото ги синтетизира своите протеини.
Во аминокиселините учествуваат 22 аминокиселини, од кои 13 можат да се претворат еден во друг, 9 - фенилаланин, триптофан, лизин, хистидин, треонин, леуцин, валин, изолеуцин, метионин - се незаменливи. Недостаток на незаменливи киселини во организмот, ова ќе доведе до нарушување на организмот.
Важно е не само фактот дека протеинот влегува во организмот, туку и од кои аминокиселини се состои!

Што е протеин?
Протеини (протеини / полипептиди) - органски супстанции, природни полимери кои содржат дваесет поврзани аминокиселини. Комбинациите обезбедуваат многу видови. Телото се справува со синтезата на дванаесет заменливи аминокиселини сама по себе.
Осум од дваесетте основни аминокиселини кои се наоѓаат во протеините, не можат сами да се синтетизираат од телото, тие се добиваат со храна. Овие се валин, леуцин, изолеуцин, метионин, триптофан, лизин, треонин, фенилаланин, кои се важни за животот.
Што се случува протеини
Разликувајте помеѓу животните и зеленчукот (по потекло). Потребни се два вида потрошувачка.
Animalивотно:
Белата јајца лесно и скоро целосно се апсорбира од телото (90-92%). Протеините на ферментирани млечни производи се малку полоши (до 90%). Протеините од свежо цело млеко се апсорбираат уште помалку (до 80%).
Вредноста на говедско месо и риба во најдобрата комбинација на есенцијални аминокиселини.
Зеленчук:
Соја, канола и памук имаат добар сооднос на аминокиселини за организмот. Кај земјоделските култури, овој сооднос е послаб.
Нема производ со идеален сооднос на аминокиселини. Правилната исхрана вклучува комбинација на протеини од животинско и растително потекло.
Основата на исхраната „според правилата“ е животински протеин. Богат е со есенцијални аминокиселини и обезбедува добра апсорпција на протеини од растително ниво.
Функции на протеините во организмот
Да се биде во клетките на ткивото, тој извршува многу функции:
- Заштитен. Функционирањето на имунолошкиот систем е неутрализирање на странски материи. Се јавува производство на антитела.
- Транспорт. Снабдување со разни супстанции, на пример, хемоглобин (снабдување со кислород).
- Регулаторна. Одржување на хормонална позадина.
- Погон. Сите видови на движење обезбедуваат актин и миозин.
- Пластика. Состојбата на сврзното ткиво се контролира со содржината на колаген.
- Каталитички. Тоа е катализатор и го забрзува поминувањето на сите биохемиски реакции.
- Зачувување и пренесување на информации за гени (молекули на ДНК и РНК).
- Енергија. Снабдување на целото тело со енергија.
Други обезбедуваат дишење, се одговорни за варењето на храната, го регулираат метаболизмот. Фотосензитивниот протеин родопсин е одговорен за визуелната функција.
Крвните садови содржат еластин, благодарение на тоа тие целосно работат. Фибриноген протеин обезбедува коагулација на крвта.
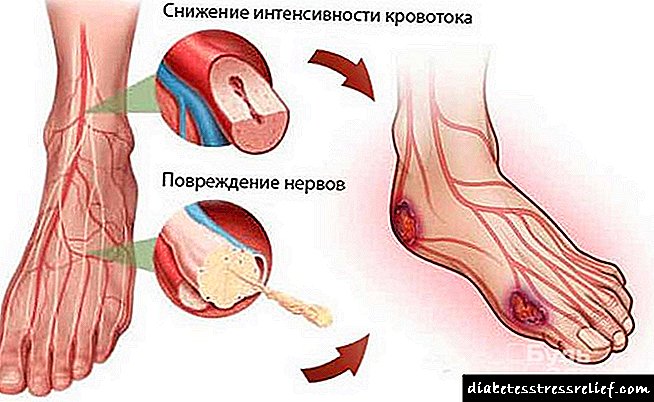
Симптоми на недостаток на протеини во организмот
Недостаток на протеини е прилично честа појава со неухранетост и хиперактивен животен стил на модерната личност. Во блага форма се изразува при редовен замор и лошо работење. Со зголемување на недоволни количини, телото сигнализира преку симптоми:
- Општа слабост и вртоглавица. Намалено расположение и активност, појава на замор на мускулите без посебен физички напор, нарушена координација на движењата, слабеење на вниманието и меморијата.
- Главоболки и влошување на спиењето. Како резултат на несоница и вознемиреност укажува на недостаток на серотонин.
- Чести промени во расположението, грутки. Недостаток на ензими и хормони предизвикува исцрпување на нервниот систем: раздразливост од која било причина, неразумна агресивност, емоционална воздржаност.
- Бледа кожа, осип. Со недостаток на протеин што содржи железо, се развива анемија, чии симптоми се сувост и бледило на кожата, мукозните мембрани.
- Отекување на екстремитетите. Ниска содржина на протеини во плазма го нарушува балансот на вода-сол. Поткожните масти акумулираат течност во глуждовите и глуждовите.
- Лошо заздравување на раните и абразии. Поправката на клетките е инхибирана поради недостаток на „градежен материјал“.
- Фрагилност и опаѓање на косата, кршливост на ноктите. Појавата на првут поради сува кожа, ексфолијација и пукање на ноктите плоча е најчестиот сигнал на телото за недостаток на протеини. Косата и ноктите постојано растат и веднаш реагираат на недостаток на супстанции кои промовираат раст и добра состојба.
- Неразумно губење на тежината. Исчезнувањето на килограмите без очигледна причина се должи на потребата телото да го надомести недостатокот на протеини поради мускулната маса.
- Неуспех на срцето и крвните садови, појава на скратен здив. Респираторниот, дигестивниот и генитоуринарниот систем исто така се влошува. Диспнеа се појавува без физички напор, кашлица без настинки и вирусни заболувања.
Со појава на симптоми од ваков вид, веднаш треба да го промените режимот и квалитетот на храната, да го преиспитате вашиот животен стил и доколку се влоши, консултирајте се со доктор.
Колку протеин е потребно за асимилација
Стапката на потрошувачка на ден зависи од возраста, полот, видот на работата. Податоците за стандардите се прикажани во табелата (подолу) и се дизајнирани за нормална тежина.
Дробење внес на протеини неколку пати е задолжително. Секој определува пригодна форма за себе, главната работа е да се одржи дневната стапка на внес.
| Работна активност + |
физичка активност
Висока содржина на протеини во храната
Признаена храна која содржи протеини:
Од сите сорти на месо, прво место по содржината на живина ќе биде говедско месо: 18,9 g После тоа, свинско месо: 16,4 g, јагнешко месо: 16,2 g.
Морските производи и лигњите се лидери: 18,0 g.
Најбогата риба за протеини е лососот: 21,8 g, потоа розовиот лосос: 21 g, штука перка: 19 g, скуша: 18 g, харинга: 17,6 g и треска: 17,5 g.
Меѓу млечните производи, кефирот и павлаката цврсто држат позиција: 3,0 g, потоа млеко: 2,8 g.
Високи зрна - Херкулес: 13,1 g, просо: 11,5 g, гриз: 11,3 g
Знаејќи ја нормата и земајќи ги предвид финансиските можности, можете правилно да составите мени и да бидете сигурни дека ќе го дополнете со масти и јаглени хидрати.
Односот на протеини во исхраната
Процентот на протеини, масти, јаглени хидрати во здрава исхрана треба да биде (во грамови) 1: 1: 4. Клучот за рамнотежата на здравото јадење може да се претстави на друг начин: протеини 25-35%, масти 25-35%, јаглени хидрати 30-50%.
Во исто време, мастите треба да бидат корисни: маслиново или ленено масло, ореви, риба, сирење.
Јаглехидратите во чинија се тврди тестенини, било кој свеж зеленчук, како и овошје / суво овошје, кисело-млечни производи.
Протеините во порции по избор може да се комбинираат: зеленчук + животни.
Аминокиселини содржани во протеини
Заменливото може да се синтетизира од самото тело, но нивното снабдување однадвор никогаш не е излишно. Особено со активен животен стил и голема физичка напор.
Сите без исклучок се важни, најпопуларните од нив:
Аланин
Го стимулира метаболизмот на јаглени хидрати, помага да се елиминираат токсините. Одговорен за „чистота“. Висока содржина во месо, риба, млечни производи.
Аргинин.
Неопходно е да се заразат какви било мускули, здрава кожа, 'рскавица и зглобови. Обезбедува согорување на маснотии и функција на имунитетниот систем. Тоа е во секое месо, млеко, какви било ореви, желатин.
Аспартална киселина.
Овозможува енергетски биланс. Ја подобрува функционалноста на централниот нервен систем. Добро надополнете го енергетскиот ресурс на јадења од говедско и пилешко месо, млеко, шеќер од трска. Содржи во компири, ореви, житарки.
Хистидин.
Главниот „градител“ на телото се претвора во хистамин и хемоглобин. Брзо заздравува рани, е одговорен за механизмите за раст. Релативно многу во млекото, житарките и секое месо.
Серена.
Невротрансмитер, неопходен за јасно функционирање на мозокот и централниот нервен систем. Постојат кикиритки, месо, житарки, соја.
Со правилна исхрана и правилен начин на живот, сите аминокиселини ќе се појават во телото за синтеза на „коцки“ и моделирање на здравје, убавина и долговечност.
Што предизвикува недостаток на протеини во организмот
- Чести заразни болести, слабеење на имунолошкиот систем.
- Стрес и вознемиреност.
- Стареење и забавување на сите метаболички процеси.
- Несакан ефект на употреба на индивидуални лекови.
- Дефекти во дигестивниот тракт.
- Повреди
- Храна базирана на брза храна, инстант производи, полу-готови производи со низок квалитет.
Недостаток на единствена аминокиселина ќе го запре производството на специфичен протеин. Телото е организирано по принципот „пополнување празнини“, така што недостасува аминокиселини ќе бидат извлечени од други протеини. Ова „обнова“ го нарушува функционирањето на органите, мускулите, срцето, мозокот и последователно ја предизвикува болеста.
Недостаток на протеини кај деца го инхибира растот, предизвикува физички и ментални пречки.
Развојот на анемија, појава на заболувања на кожата, патологија на коскеното и мускулното ткиво не е комплетен список на болести. Тешка протеинска дистрофија може да резултира во лудило и кваширкор (тип на тешка дистрофија поради недостаток на протеини).
Кога протеините му штетат на организмот
- вишок прием
- хронични заболувања на црниот дроб, бубрезите, срцето и крвните садови.
Преголемата потрошувачка не се случува често поради нецелосна апсорпција на супстанција од страна на телото.Се јавува кај оние кои сакаат што побрзо да ги зголемат мускулите, без да ги следат препораките на тренери и нутриционисти.
Проблемите со „вишокот“ на прием вклучуваат:
Бубрежна слабост. Преголеми количини на органи со преоптоварување со протеини, нарушувајќи ја нивната природна функција. "Филтерот" не може да се справи со товарот, се појавува болест на бубрезите.
Заболување на црниот дроб. Вишокот протеин акумулира амонијак во крвта, што ја влошува состојбата на црниот дроб.
Развој на атеросклероза. Повеќето животински производи, покрај корисни материи, содржат штетни масти и холестерол.
Луѓето кои страдаат од патологија на црниот дроб, бубрезите, кардиоваскуларните и дигестивните системи треба да го ограничат внесот на протеини.
Грижата за сопственото здравје им се наградува удобно на оние што се грижат за тоа. За да избегнете сериозни последици, треба да ја запомните потребата на телото за закрепнување. Целосен одмор, исхрана, посета на специјалисти ќе ги продолжи младоста, здравјето и животот.
Растворливост
Протеините се разликуваат во растворливоста во водата. Растворливи во вода протеини се нарекуваат албумин, овие вклучуваат крвни и млечни протеини. Да се нерастворливи, или склеропротеини, вклучуваат, на пример, кератин (протеинот што ја сочинува косата, косата од цицачите, пердувите на птиците и сл.) И фибронот, кој е дел од свилата и пајажина. Растворливоста на протеинот се определува не само од неговата структура, туку и од надворешните фактори, како што се природата на растворувачот, јонската јачина и pH на растворот.
Протеините исто така се поделени на хидрофилни (растворливи во вода) и хидрофобни (отпорни на вода). Повеќето протеини на цитоплазмата, јадрото и меѓуклеточната супстанција, вклучувајќи нерастворлив кератин и фиброин, се хидрофилни. Повеќето протеини што сочинуваат биолошки мембрани се хидрофобни - интегрални протеински мембрани кои комуницираат со хидрофобни липиди на мембраната (овие протеини, како по правило, имаат и хидрофилни места).
Биосинтеза на протеините во организмот
Биосинтеза на протеините - формирање во телото на посакуваните протеини од аминокиселини со комбинирање на нив со посебен вид хемиска врска - полипептид синџир. ДНК ги чува информациите за структурата на протеините. Самата синтеза се одвива во посебен дел од клетката наречена рибозом. РНК ги пренесува информациите од посакуваниот ген (страница на ДНК) во рибозомот.
Бидејќи протеинската биосинтеза е повеќестепена, комплексна, ги користи информациите утврдени во основата на човековото постоење - ДНК, нејзината хемиска синтеза е тешка задача. Научниците научиле како да се добијат инхибитори на одредени ензими и хормони, но најважната научна задача е да се добијат протеини со помош на генетско инженерство.

Транспорт
Транспортната функција на специјален протеин во крвта - хемоглобин. Благодарение на овој протеин, кислородот се доставува од белите дробови до органите и ткивата на телото.
Се состои во активност на протеини на имунолошкиот систем наречени антитела. Тоа е антитела што го чуваат здравјето на телото, го штитат од бактерии, вируси, отрови и му овозможуваат на крвта да формира тромб наместо отворена рана.
Функцијата на сигналот на протеините е да пренесува сигнали (информации) помеѓу клетките.
Протеини норми за возрасен
Потребата на човечкото тело за протеини директно зависи од неговата физичка активност. Колку повеќе се движиме, толку побрзо напредуваат сите биохемиски реакции во нашето тело. Луѓето кои редовно вежбаат им треба скоро двојно повеќе протеини од просечната личност. Недостаток на протеини за луѓето вклучени во спортот е опасно „сушење“ на мускулите и исцрпеност на целото тело!
Во просек, протеинската норма за возрасно лице се пресметува врз основа на коефициент од 1 g протеини на 1 кг тежина, т.е. приближно 80-100 g за мажи, 55-60 g за жени. На машките спортисти им се советува да ја зголемат количината на консумирани протеини на 170-200 g на ден.

Правилна протеинска исхрана за организмот
Правилната исхрана за заситеност на организмот со протеини е комбинација на животински и растителни протеини. Степенот на асимилација на протеините од храната зависи од неговото потекло и методот на термичка обработка.
Така, приближно 80% од вкупниот внес на протеини од животинско потекло и 60% растителни протеини се апсорбираат од страна на телото. Производите од животинско потекло содржат поголема количина на протеини по единица маса на производот отколку во зеленчукот. Покрај тоа, составот на "животински" производи ги вклучува сите аминокиселини, а растителните производи во овој поглед се сметаат за инфериорни.
Основни правила за исхрана за подобра апсорпција на протеините:
- Нежен начин на готвење - готвење, пареа, чорба. Пржењето треба да се исклучи.
- Се препорачува да се јаде повеќе риби и живина. Ако навистина сакате месо, изберете говедско месо.
- Супите треба да бидат исклучени од исхраната, тие се масни и штетни. Во екстремни случаи, можете да готвите првото јадење со помош на "секундарна супа".
Карактеристики на протеинска исхрана за раст на мускулите
Спортистите кои активно стекнуваат мускулна маса треба да се придржуваат кон сите горенаведени препораки. Повеќето од нивната исхрана треба да бидат протеини од животинско потекло. Тие треба да се јадат заедно со растителни протеински производи, од кои соја е особено предност.
Исто така, неопходно е да се консултирате со лекар и да размислите за употреба на специјални протеински пијалоци, чиј процент на апсорпција на протеини е 97-98%. Специјалистот индивидуално ќе избере пијалок, ќе ја пресмета точната доза. Ова ќе биде пријатен и корисен додаток на протеини за обука на сила.
Денатурација
Денатурација на протеини се однесува на какви било промени во неговата биолошка активност и / или физичкохемиски својства поврзани со губење на кватернерна, терцијарна или секундарна структура (види дел „Протеинска структура“). Како по правило, протеините се прилично стабилни во тие услови (температура, pH вредност, итн.) Во кои тие нормално функционираат во организмот. Остра промена во овие услови доведува до денатурација на протеините. Во зависност од природата на средството за денатурирање, се разликуваат механичко (силно мешање или тресење), физичко (греење, ладење, зрачење, сонификација) и хемиски (киселини и алкалии, сурфактанти, уреа) денатурација.
Денатурацијата на протеините може да биде целосна или делумна, реверзибилна или неповратна. Најпознат случај на неповратно протеини денатурирање на протеините во секојдневниот живот е подготовката на пилешко јајце, кога, под влијание на висока температура, растворливиот во вода протеински овалбумин станува густ, нерастворлив и непроaирен. Денаутацијата во некои случаи е реверзибилна, како во случај на таложење на растворливи во вода протеини со употреба на соли на амониум (метод на солење), а овој метод се користи како начин за нивно чистење.
Протеинските молекули се линеарни полимери што се состојат од остатоци од α-L-аминокиселини (кои се мономери), а исто така модифицирани остатоци од аминокиселини и компоненти од не-аминокиселинска природа можат да бидат вклучени во составот на протеини. Во научната литература, една или три букви кратенки се користат за да се однесуваат на аминокиселини. Иако на прв поглед може да изгледа дека употребата на „само“ 20 типа аминокиселини кај повеќето протеини ја ограничува различноста на протеинските структури, всушност, бројот на опции тешко може да се прецени: за ланец од 5 остатоци од аминокиселини, тој е веќе повеќе од 3 милиони, и ланец од 100 остатоци од аминокиселини (мал протеин) може да биде претставен во повеќе од 10.130 варијанти. Протеини од 2 до неколку десетици остатоци од аминокиселини во должина често се нарекуваат пептиди, со поголем степен на полимеризација - верверички, иако оваа поделба е многу произволна.
Кога протеинот се формира како резултат на интеракцијата на а-карбоксилната група (-COOH) на една аминокиселина со а-амино групата (-NH2) на друга аминокиселина се формираат пептидни врски. Краевите на протеинот се нарекуваат N- и C-терминал, во зависност од тоа која од групите на терминалниот остаток на аминокиселини е слободен: -NH2 или -COOH, соодветно. Во синтеза на протеини на рибозомот, првиот (Н-терминален) остаток на аминокиселини е обично остаток на метионин, а последователните остатоци се прикачени на Ц-терминалот од претходниот.
Карактеристики на протеинска исхрана, диети
Оние кои сакаат да изгубат тежина треба да јадат животински и растителни протеински производи. Важно е да се раздели нивниот внес, затоа што времето за нивна асимилација е различно. Производите за масно месо треба да се исфрлат, компирите не треба да се злоупотребуваат, треба да се претпочитаат житарките со просечна содржина на протеини.
Не одете во крајности и „седнете“ на протеинска диета. Не одговара на сите, затоа што целосното исклучување на јаглени хидрати ќе доведе до намалување на работниот капацитет и енергија. Доволно е да се јаде храна која содржи јаглени хидрати наутро - ова ќе ви даде енергија во текот на денот, во попладневните часови, јадете протеинска храна со малку протеини. За да се надомести недостаток на енергија во вечерните часови, телото ќе започне да согорува маснотии на телото, сепак, овој процес ќе биде безбеден за здравјето на организмот.
Бидете сигурни дека вклучете ја правилната и правилно подготвената протеинска храна во вашата диета. За телото, протеинот е главниот градежен материјал! Заедно со редовниот тренинг, ќе ви помогне да изградите прекрасно атлетско тело!
Протеините се најважните хемиски соединенија, без кои виталната активност на организмот би била невозможна. Протеините се состојат од ензими, клетки на органи, ткива. Тие се одговорни за метаболизмот, транспортот и многу други процеси што се случуваат во човечкото тело. Протеините не можат да се акумулираат „во резерва“, затоа мора редовно да се внесуваат. Тие се од особено значење за луѓето вклучени во спортот, бидејќи протеините се регулираат.
Ниво на организација

К. Линдстром-Ланг предложи да се издвојат 4 нивоа на структурна организација на протеините: примарни, секундарни, терциерни и кватернерни структури. Иако оваа поделба е малку застарена, таа и понатаму се користи. Примарната структура (низа на остатоци од аминокиселини) на полипептид е одредена со структурата на неговиот ген и генетски код, а структурите со повисоки нарачки се формираат за време на преклопувањето на протеините. Иако просторната структура на протеините како целина е одредена од нејзината аминокиселинска секвенца, таа е доста лабилна и може да зависи од надворешни услови, затоа е поправилно да се зборува за претпочитаната или најенергично поволната конфигурација на протеините.
Примарна структура

Примарната структура е низата остатоци од аминокиселини во полипептидниот ланец. Примарната структура на протеинот обично се опишува со употреба на единечни или три букви за остатоци од аминокиселини.
Важни карактеристики на примарната структура се конзервативните мотиви - стабилни комбинации на остатоци од аминокиселини кои вршат одредена функција и се наоѓаат во многу протеини. Конзервативните мотиви се зачувани за време на еволуцијата на видовите, често е можно да се предвиди функцијата на непознат протеин од нив. Степенот на хомологија (сличност) на аминокиселинските секвенци на протеини од различни организми може да се искористи за да се процени еволутното растојание помеѓу таксоните на кои припаѓаат овие организми.
Примарната структура на протеинот може да се утврди со методи за секвенционирање на протеини или со примарна структура на нејзината mRNA со помош на табелата за генетски код.
Секундарна структура
Секундарната структура е локалното нарачување на фрагмент од полипептиден ланец стабилизиран со водородни врски.Следниве се најчестите видови на секундарна структура на протеини:
- α-хелики се густи вртења околу долгата оска на молекулот. Едно вртење е 3,6 аминокиселински остатоци, теренот на хеликс е 0,54 nm (0,15 nm паѓа на еден остаток на аминокиселини). Спиралата се стабилизира со водородни врски помеѓу групите H и O, со растојание од 4 единици. Иако α-хеликс може да биде лево или десна, десната рака преовладува во протеините. Спиралата е нарушена со електростатските интеракции на глутаминска киселина, лизин, аргинин. Блиску едни до други, остатоците од аспарагин, серин, треонин и леуцин можат стерилно да се мешаат во формирањето на хеликс, остатоците од пролин предизвикуваат свиткување на ланецот и исто така нарушуваат α-хелики,
- β-листовите (преклопени слоеви) се неколку цик-цак полипептидни ланци во кои водородните врски се формираат помеѓу релативно оддалечени едни од други (0,34 nm по остаток на аминокиселини) аминокиселини во примарната структура или различни синџири на протеини (наместо тесно распоредени, како што е случај биде во α-хеликс). Овие ланци обично се насочени од страна на N-краевите во спротивни насоки (антипаралелна ориентација) или во една насока (паралелна β-структура). Исто така е можно постоење на мешана β-структура која се состои од паралелни и антипаралелни β-структури. За формирање на β-листови, важни се мали димензии на страничните групи на аминокиселини, обично преовладуваат глицин и аланин,
- π-хеликс
- 310спирали
- неправилни фрагменти.
Терциерна структура

Терциерната структура е просторна структура на полипептидниот ланец. Структурно, се состои од елементи на секундарна структура стабилизирана од разни видови интеракции во кои хидрофобните интеракции играат клучна улога. Стабилизацијата на терциерната структура вклучува:
- ковалентни врски (помеѓу двата остатоци од цистеин - мостови на дисулфид),
- јонски врски помеѓу спротивно наелектни странични групи на остатоци од аминокиселини,
- водородни врски
- хидрофобни интеракции. Кога комуницирате со околните молекули на водата, протеинскиот молекул е преклопен така што неполарните странични групи на аминокиселини се изолираат од водниот раствор, а на површината на молекулот се појавуваат поларни хидрофилни странични групи.
Студиите за принципите на преклопување на протеините покажаа дека е погодно да се разликува друго ниво помеѓу нивото на секундарната структура и атомската просторна структура - матниот мотив (архитектура, структурен мотив). Мотивот за стајлинг се определува со взаемно уредување на секундарните елементи на структурата (α-хелики и β-нишки) во рамките на протеинскиот домен - компактен глобул што може да постои или сам по себе или да биде дел од поголем протеин заедно со други домени. На пример, разгледајте еден од карактеристичните мотиви на структурата на протеините. Глобуларен протеин прикажан на сликата десно, триозофосфатизомераза, има преклопен мотив наречен α / β-цилиндер: 8 паралелни β-нишки формираат β-цилиндер во друг цилиндер составен од 8 α-хелицери. Овој мотив се наоѓа кај околу 10% од протеините.
Познато е дека стилските мотиви се прилично конзервативни и ги има во протеините кои немаат ниту функционални ниту еволутивни односи. Определувањето на стилови на стилизирање е во основата на физичката, или рационалната класификација на протеините (како што е CATH или SCOP).
За да се утврди просторна структура на протеинот, се користат методи за анализа на дифракција на рентген, нуклеарна магнетна резонанца и некои видови микроскопија.
Квартарна структура
Кварталната структура (или под-единицата, доменот) е взаемно уредување на неколку полипептидни ланци како дел од еден протеински комплекс.Протеинските молекули што го сочинуваат протеинот со кватернерна структура се формираат одделно на рибозомите и само по завршувањето на синтезата формираат заедничка супрамолекуларна структура. Квартарен протеин може да содржи и идентични и различни полипептидни ланци. Стабилизацијата на кватернерската структура вклучува исти видови на интеракции како и во стабилизацијата на терциер. Супрамолекуларни протеински комплекси можат да се состојат од десетици молекули.
Класификација според видот на зградата
Протеините можат да се поделат во три групи според општиот вид структура:
- Фибриларни протеини - формираат полимери, нивната структура е обично многу редовна и е поддржана главно од интеракции помеѓу различни ланци. Тие формираат микрофиламенти, микротубули, фибрили и ја поддржуваат структурата на клетките и ткивата. Фибриларните протеини вклучуваат кератин и колаген.
- Глобуларните протеини се растворливи во вода, општата форма на молекулот е повеќе или помалку сферична.
- Мембрански протеини - имаат домени што ја пресекуваат клеточната мембрана, но делови од нив излегуваат од мембраната во меѓуклеточната средина и клеточната цитоплазма. Мембранските протеини делуваат како рецептори, односно пренесуваат сигнали, а исто така обезбедуваат и трансмембрано превоз на разни супстанции. Транспортерите на протеините се специфични, секој од нив минува само одредени молекули или одреден вид на сигнал низ мембраната.
Едноставни и сложени протеини
Покрај пептидните ланци, многу протеини вклучуваат и не-аминокиселински групи, а според овој критериум, протеините се поделени во две големи групи - едноставни и сложени протеини (протеиди). Едноставни протеини се состојат само од полипептидни ланци, сложените протеини содржат и не-аминокиселини или протетички групи. Во зависност од хемиската природа на протетичките групи, следниве класи се разликуваат меѓу сложените протеини:
- Гликопротеините кои содржат ковалентно поврзани остатоци од јаглени хидрати како протетичка група, гликопротеините кои содржат остатоци од мукополисахариди припаѓаат во подкласата на протеогликаните. Хидроксилни групи на серин или треонин обично се вклучени во формирањето на врската со остатоци од јаглени хидрати. Повеќето екстрацелуларни протеини, особено имуноглобулините, се гликопротеини. Кај протеогликаните, делот на јаглени хидрати е
95% од вкупната маса на протеинскиот молекул, тие се главната компонента на меѓуклеточната матрица, т.
2. Биолошкото значење на репродукцијата на организмите. Методи на репродукција.
1. Репродукција и нејзиното значење.
Репродукција - репродукција на слични организми, што обезбедува
постоењето на видови за многу милениуми придонесува за зголемување на
бројот на индивидуите на видот, континуитетот на животот. Асексуални, сексуални и
вегетативно размножување на организмите.
2. Асексуалната репродукција е најстариот начин. Во
еден организам е вклучен во сексуалноста, додека најчесто учествува во сексуално
две лица. Кај растенијата, асексуална репродукција со употреба на спори - еден
специјализирани ќелии. Размножување од спори на алги, мов, конска опашка,
грабежи, папрати. Осип на спори од растенија, нивно ртење и развој на
нив нови помошни организми во поволни услови. Смрт на огромен број
спорот спаѓа во неповолни услови. Мала веројатност за појава
нови организми од спори, бидејќи содржат малку хранливи материи и
расад ги апсорбира главно од околината.
3. Вегетативно размножување - размножување на растенија со
користење вегетативни органи: воздушни или подземни пука, делови од коренот,
лист, клубенот, светилки. Учество во вегетативно размножување на еден организам
или нивни делови. Афинитет на ќерката растение со мајката, како што е
го продолжува развојот на телото на мајката. Голема ефикасност и
ширењето на вегетативно размножување во природата, како помошен организам
формирана побрзо од мајчинскиот дел отколку од спорот. Вегетативни примери
размножување: користење ризоми - крин на долината, нане, пченица, итн., искоренување
долни гранки што ја допираат почвата (слоевитоста) - рибизли, диво грозје, мустаќи
- јагоди, луковици - лале, дафодил, кроккус. Употреба на вегетативно
одгледување при одгледување на култивирани растенија: компирите се размножуваат со клубени,
светилки - кромид и лук, слоевит - рибизли и огрозд, корен
потомство - цреша, слива, сечи - овошни дрвја.
4. Сексуална репродукција. Суштината на сексуалната репродукција
при формирање на микроб клетки (гамети), фузија на машката микроб клетка
(сперма) и женски (јајце) - ѓубрење и развој на ново
организмот ќерка од оплодено јајце. Благодарение на оплодувањето
супсидијарен организам со поразновиден сет на хромозоми, што значи со повеќе
разни наследни карактеристики, како резултат на што може да испадне дека е
повеќе прилагодени на живеалиштата. Присуство на сексуална репродукција во
алги, мов, папрати, гимнасперми и ангиосперми. Компликација
сексуалниот процес во растенијата за време на нивната еволуција, појавата на најсложените
форми во семенски растенија.
5. Размножувањето на семето се случува со помош на семе,
карактеристичен е за гимнаспермите и ангиоспермите (ангиосперми
растителното размножување е исто така распространето). Секвенца на чекори
размножување на семе: опрашување - пренесување на поленот на стигмата на пиштол, негово
ртење, појава со делење на две сперматозоиди, нивниот напредок во
овула, потоа фузија на едната сперма со јајце, а другата со
секундарно јадро (кај ангиосперми). Формирање на семе од овула -
ембрионот со снабдување со хранливи материи, а од theидовите на јајниците - фетусот. Семе -
микроб на ново растение, во поволни услови, никнува и прв пат
расад се храни од хранливите материи на семето, а потоа и нејзините корени
почнуваат да апсорбираат вода и минерали од почвата, а лисјата - јаглерод диоксид
гас од воздухот на сончева светлина. Независниот живот на ново растение.
Протеинска биофизика
Физички својства на протеинот во ќелијата, водејќи сметка за водената мембрана и набивањето макромолекули (инж.) многу комплицирано Хипотезата за протеинот како нарачан „систем налик на кристал“ - „апериодичен кристал“ - е поддржана со анализа на дифракција на рендгенски зраци (до резолуција од 1 ангстром), висока густина на пакување, кооперативност на процесот на денатурирање и други факти.
Во прилог на друга хипотеза, течните слични својства на протеините во процесите на интраглобуларни движења (модел на ограничено скокање или континуирана дифузија) се потврдени со експерименти за расејување на неутрони, спектроскопија на Mssbauer.

Универзален метод: синтеза на рибозом
Протеините се синтетизираат од живи организми од аминокиселини врз основа на информации кодирани во гените. Секој протеин се состои од единствена низа на остатоци од аминокиселини, која е одредена со нуклеотидната низа на генот што го кодира протеинот. Генетскиот код е метод за преведување на нуклеотидната секвенца на ДНК (преку РНК) во низата на аминокиселини на полипептидниот ланец. Овој код ја одредува кореспонденцијата на тринуклеотидните делови на РНК, наречени кодони и одредени аминокиселини што се вклучени во протеинот: низата на нуклеотид AUG, на пример, одговара на метионин. Бидејќи ДНК се состои од четири вида нуклеотиди, вкупниот број на можни кодони е 64, а со оглед на тоа што во протеините се користат 20 аминокиселини, многу аминокиселини се одредуваат со повеќе од еден кодон. Три кодони се незначителни: тие служат како стоп-сигнали за синтеза на полипептидниот ланец и се нарекуваат кодони за завршување, или стоп кодонови.
Гените што кодираат протеини први се транскрибираат во нуклеотидната секвенца на гласникот РНК (mRNA) од ензимите РНК полимераза. Во огромно мнозинство на случаи, протеините на живите организми се синтетизираат на рибозоми - мултикомпонентни молекуларни машини присутни во цитоплазмата на клетките. Процесот на синтетизирање на полипептидниот ланец од страна на рибозом на мРНА матрица се нарекува превод.
Синтезата на рибозомални протеини е фундаментално иста во прокариотите и еукариотите, но се разликува во некои детали. Така, прокариотската mRNA може да се прочита со рибозоми во аминокиселинската секвенца на протеините веднаш по транскрипцијата или дури и пред нејзиното завршување. Кај еукариотите, примарниот препис прво мора да помине низ серија модификации и да се пресели во цитоплазмата (до локацијата на рибозомот), пред да започне преводот. Стапката на синтеза на протеини е повисока кај прокариотите и може да достигне 20 аминокиселини во секунда.

Дури и пред почетокот на преводот, ензимите на аминоацил-tRNA синтетаза специјално прикачуваат аминокиселини на соодветната RNA за транспорт (tRNA). Регион tRNA, наречен антикодон, може комплетно да се спари со mRNA кодон, со што ќе се обезбеди вклучување на остаток на аминокиселини прикачен на tRNA во полипептидниот ланец во согласност со генетскиот код.
За време на почетната фаза на преводот, иницијацијата, коденот за иницијатор (обично метионин) се препознава со малата подружница на рибозомот, на која се прицврстува аминоацилираниот метионин tRNA користејќи протеински фактори на иницијација. По препознавањето на почетниот кодеон, големата субјект се придружува на малата поддиница на рибозомот и започнува втората фаза на преводот, издолжувањето. На секој чекор на рибозомот од 5'- до 3'-крајот на mRNA, се чита еден кодон со формирање водородни врски помеѓу него и транспортот РНК комплементарна со неа, на која е прикачен соодветниот остаток на аминокиселини. Формирањето на пептидна врска помеѓу последниот остаток на аминокиселини на растечкиот пептид и остатоци од аминокиселини прикачени на tRNA се катализира со рибозомална РНК (rRNA), која го формира центарот на пептидил трансфераза на рибозомот. Овој центар ги поставува атомите на азот и јаглерод во позиција поволна за премин на реакцијата. Третата и последната фаза на превод, завршување, се јавува кога рибозомот ќе го достигне стоп-коденот, по што факторите на прекинување на протеините ја хидролизираат врската помеѓу последната tRNA и полипептидниот ланец, запирајќи ја неговата синтеза. Во рибозомите, протеините секогаш се синтетизираат од N- до C-терминалот.
Нерибозомска синтеза
Кај долните габи и некои бактерии, познат е дополнителен (не-рибозомски или мултиензим) метод на биосинтеза на пептиди, обично од мала и необична структура.Синтезата на овие пептиди, обично секундарни метаболити, се спроведува од протеински комплекс со висока молекуларна тежина, NRS синтеза, без директно учество на рибозоми. NRS синтезата обично се состои од неколку домени или индивидуални протеини кои избираат аминокиселини, формираат пептидна врска и ослободуваат синтетизиран пептид. Заедно, овие домени го сочинуваат модулот. Секој модул обезбедува вклучување на една аминокиселина во синтетизираниот пептид. NRS синтезата на тој начин може да биде составена од еден или повеќе модули. Понекогаш, овие комплекси вклучуваат домен способен за изомеризирање на L-аминокиселините (нормална форма) во Д-форма.
Хемиска синтеза
Кратките протеини можат да се синтетизираат хемиски користејќи методи на органска синтеза, на пример, хемиско лигатурање. Најчесто, хемиската синтеза на пептидот се јавува во правец од С-терминалот кон Н-терминалот, наспроти биосинтезата на рибозом. Методот на хемиска синтеза произведува кратки имуногени пептиди (епитопи), кои потоа се инјектираат кај животни со цел да се добијат специфични антитела или хибридоми. Покрај тоа, овој метод се користи и за добивање на инхибитори на одредени ензими. Хемиската синтеза овозможува воведување на остатоци од аминокиселини кои не се наоѓаат во конвенционалните протеини, на пример, оние со етикети со флуоресценција прикачени на нивните странични ланци. Хемиските методи за синтеза на протеините имаат неколку ограничувања: тие се неефикасни со протеинска должина од повеќе од 300 остатоци од аминокиселини, вештачки синтетизирани протеини може да имаат неправилна терцијарна структура и немаат карактеристични пост-преводни модификации (види подолу).
Пост-преводна модификација

По завршувањето на преводот, повеќето протеини се подложуваат на понатамошни хемиски модификации наречени модификации по пост-превод Познати се повеќе од двесте варијанти на пост-преводна модификација на протеините.
После преводните модификации може да се регулира животниот век на протеините во клетката, нивната ензимска активност и интеракциите со други протеини. Во некои случаи, пост-преводните модификации се задолжителна фаза на созревање на протеините, во спротивно е функционално неактивна. На пример, со созревање на инсулин и некои други хормони, потребна е ограничена протеолиза на полипептидниот ланец, а со созревањето на протеините во плазма мембрана, потребна е гликозилација.
Пост-преводните модификации можат да бидат широко распространети и ретки, до уникатни. Пример за универзална модификација е сеприсутинација (прицврстување на ланец на неколку молекули на краткиот протеин на убиквитин на протеин), што служи како сигнал за расцепување на овој протеин од страна на протеазомот. Друга вообичаена модификација е гликозилацијата - се проценува дека околу половина од човечките протеини се гликозилирани. Ретки модификации вклучуваат тирозинација / дерирозинација и полиглицелација на тубулин.
Еден ист протеин може да претрпи бројни модификации. Значи, хистоните (протеините кои се дел од хроматинот во еукариотите) под различни услови можат да претрпат повеќе од 150 различни модификации.
Пост-преводните измени се поделени на:
- главни модификации на колото,
- расцеп на N-терминалниот остаток на метионин,
- ограничена протеолиза - отстранување на протеински фрагмент што може да се појави од краевите (разделување на сигналните секвенци) или, во некои случаи, во средина на молекулата (созревање на инсулин),
- приврзаност на различни хемиски групи во ослободување на амино и карбоксилни групи (Н-ацилација, миристоилација и др.),
- модификација на страничните ланци на аминокиселини,
- додавање или расцеп на мали хемиски групи (гликозилација, фосфорилација, итн.),
- додавање на липиди и јаглеводороди,
- промена на стандардни остатоци на аминокиселини во нестандардни (формирање на цитрулин),
- формирање на дисулфидни мостови помеѓу остатоци од цистеин,
- додавање на мали протеини (суоолација и сеприсутинација).
Интрацелуларен транспорт и сортирање
Протеините кои се синтетизираат во цитоплазмата на еукариотската клетка, мора да се транспортираат во различни клеточни органоиди: јадрото, митохондрија, ендоплазматски ретикулум (EPR), апарати Голги, лизозоми, итн., А некои протеини мора да влезат во вонлеточниот медиум. За да влезете во одреден дел од ќелијата, протеинот мора да има специфична етикета. Во повеќето случаи, таквата етикета е дел од аминокиселинската секвенца на самиот протеин (лидер пептид или сигнална секвенца на протеинот), но во некои случаи, олигосахаридите прикачени на протеинот се етикетата.
Транспортот на протеини во EPR се одвива како што се синтетизираат, бидејќи рибозомите синтетизираат протеини со сигнална секвенца за EPR „седат“ на специјални протеини на нејзината надворешна мембрана. Од ИПР до апаратот Голги, и од таму до лизозомите и надворешната мембрана или до екстрацелуларниот медиум, протеините влегуваат преку везикуларен транспорт. Протеините со нуклеарна локализација на сигналот влегуваат во јадрото преку нуклеарни пори. Во митохондриите и хлоропластите, протеините кои ги поседуваат соодветните сигнални секвенци, влегуваат низ специфични пори на протеински преведувачи со учество на шперони.
Одржување на структурата и деградацијата
Одржувањето на правилната просторна структура на протеините е клучно за нивно нормално функционирање. Неправилното преклопување на протеините што доведува до нивно агрегација може да биде предизвикано од мутации, оксидација, услови на стрес или глобални промени во физиологијата на клетката. Агрегацијата на протеините е карактеристичен знак на стареење. Се верува дека неправилното преклопување на протеините е причина или егзацербација на болести како што се цистична фиброза, лизозомска акумулација болест. како и невродегенеративни нарушувања (Алцхајмерова, Хантингтон и Паркинсон).
Во процесот на еволуција на клетките, развиени се четири главни механизми за да се спротивстави на агрегацијата на протеините. Првите две - повторено преклопување (преполнување) со помош на саперони и расцеп со протеази - се наоѓаат и кај бактерии и кај повисоки организми. Автофагијата и акумулацијата на неправилно склопените протеини во специјалните немембраниски органели се карактеристични за еукариотите.

Способноста на протеините да ја обноват точната тродимензионална структура по денатурирање, ни овозможи да претпоставиме дека сите информации за конечната структура на протеините се содржани во нејзината низа на аминокиселини. Во моментов, теоријата дека стабилната конформација на протеинот има минимална бесплатна енергија се споредува со другите можни сообразности на овој полипептид.
Во клетките постои група на протеини чија функција е да се обезбеди правилно преклопување на други протеини по нивната синтеза на рибозомот, да се врати структурата на протеините по нивното оштетување, како и создавање и дисоцијација на протеински комплекси. Овие протеини се нарекуваат каперони. Концентрацијата на многу шаперони во ќелијата се зголемува со нагло зголемување на температурата на околината, така што тие припаѓаат на групата Hsp (англиски протеини со топлински шок - протеини од топлотен шок). Важноста на нормалното функционирање на chaperones за функционирање на телото може да се илустрира со примерот на α-кристалин саперон, кој е дел од леќи на човечкото око. Мутациите во овој протеин доведуваат до заоблување на леќата поради агрегација на протеините и, како резултат на тоа, на катаракта.
Ако терциерната структура на протеините не може да се врати, тие се уништуваат од клетката. Ензимите што ги деградираат протеините се нарекуваат протеази.На местото на напад на молекулата на подлогата, протеолитичките ензими се поделени во ендопептидази и егзопептидази:
- Ендопептидаза, или протеинази, ги разложуваат пептидните врски во синџирот на пептид. Тие ги препознаваат и врзуваат кратките сексуални секвенци на подлоги и релативно конкретно ги хидролизираат врските помеѓу одредени остатоци од аминокиселини.
- Егзопептидаза ги хидролизира пептидите од краевите на ланецот: аминопептидази од Н-терминалот, карбоксипептидази од С-терминалот. Конечно, дипептидазите ги разложуваат само дипептидите.
Според механизмот за катализа, Меѓународната унија за биохемија и молекуларна биологија идентификува неколку класи на протеази, вклучително и серински протеази, аспартични протеази, цистеин протеази и металопротеази.
Посебен вид на протеаза е протеазомот, голем мултисубунит протеаза присутен во јадрото и цитоплазмата на еукариотите, архиите и некои бактерии.
За да може целниот протеин да се расцепи со протеазомот, тој мора да биде етикетиран со приложување на мал протеин во протеин. Дополнителната реакција на убиквитин се катализира со ензимите убикитин лигази. Додавањето на првиот молекула на убикитин во протеинот служи како сигнал за лигази за понатамошно додавање на молекули на убиквитин. Како резултат, полиубиквитин синџир е прикачен на протеинот, кој се врзува за протеазомот и обезбедува расцеп на целниот протеин. Во принцип, овој систем се нарекува деградација на протеини зависен од ubiquitin. Деградацијата на 80-90% од интрацелуларните протеини се јавува со учество на протеазомот.
Деградацијата на протеините кај пероксизомите е важна за многу клеточни процеси, вклучувајќи го и клеточниот циклус, регулирање на изразот на гени и одговор на оксидативниот стрес.

Автофагијата е процес на деградација на долговечните биомолекули, особено протеините, како и органелите во лизозомите (кај цицачите) или вакуолите (во квасецот). Автофагијата ја придружува виталната активност на која било нормална клетка, но недостатокот на хранливи материи, присуството на оштетени органели во цитоплазмата и, конечно, присуството на делумно денатурирани протеини и нивните агрегати во цитоплазмата може да послужат како стимули за подобрување на процесите на автофагија во клетките.
Се разликуваат три вида на автофагија: микроатофагија, макроаутофагија и автофагија зависна од каперон.
За време на микроатофагијата, макромолекулите и фрагментите на клеточните мембрани се заробени од лизозомот. На овој начин, клетката може да вари протеини со недостаток на енергија или градежен материјал (на пример, за време на глад). Но, процесите на микроатофагија се случуваат во нормални услови и генерално се недискриминирачки. Понекогаш, органоидите се варат за време на микроатофагијата, на пример, микроатофагија на пероксизоми и делумна микроатофагија на јадрата во која клетката останува одржлива е опишана во квасец.
Во макроатофагија, дел од цитоплазмата (често содржи какви било органоиди) е опкружена со мембрански оддел сличен на цистерна на ендоплазматскиот ретикулум. Како резултат, оваа страница е одделена од остатокот од цитоплазмата со две мембрани. Ваквите органели со двојна мембрана се нарекуваат автофагозоми. Автофагозомите се спојуваат со лизозомите, формирајќи автофаголизозоми, во кои се вари органели и остатокот од содржината на автофагозомите. Очигледно, макроатофагијата е исто така неселективна, иако често се потенцира дека со помош на тоа ќелијата може да се ослободи од органоиди кои се „застарени“ (митохондрија, рибозоми и сл.).
Третиот вид на автофагија е зависен од chaperone. Со овој метод се јавува режиран транспорт на делумно денатурирани протеини од цитоплазмата преку лизозомската мембрана до нејзината празнина, каде што се вари. Овој вид автофагија, опишан само кај цицачи, е предизвикан од стрес.

JUNQ и IPOD
Под стрес, кога еукариотската клетка не може да се справи со акумулацијата на голем број на денатурирани протеини, тие можат да бидат испратени до еден од двата типа на привремени органели - JUNQ и IPOD (англиски) руски. .
JUNQ (оддел за контрола на квалитетот на нуклеарната струја JUxta) е поврзан со надворешната страна на нуклеарната мембрана и содржи убукицинирани протеини кои можат брзо да се пренесат во цитоплазмата, како и каперони и протеазозоми. Намената функција на JUNQ е да ги прераскажува и / или деградира протеините.
IPOD (Нерастворлив протеини во англиски јазик - место за таложење на нерастворливи протеини) се наоѓа во близина на централната вакуола и содржи неподвижни агрегати на амилоидни протеини што создаваат. Акумулацијата на овие протеини во IPOD може да ја спречи нивната интеракција со нормални клеточни структури, затоа, се верува дека ова вклучување има заштитна функција.
Функциите на протеините во организмот
Како и другите биолошки макромолекули (полисахариди, липиди и нуклеински киселини), протеините се основни компоненти на сите живи организми и играат важна улога во животот на клетката. Протеините вршат метаболички процеси. Тие се дел од меѓуклеточните структури - органели и цитоскелети, секретирани во воклеточниот простор, каде можат да дејствуваат како сигнал пренесен помеѓу клетките, да учествуваат во хидролизата на храната и формирање на меѓуклеточна супстанција.
Класификацијата на протеините според нивните функции е прилично произволна, бидејќи истиот протеин може да изврши неколку функции. Добро проучен пример за ваква мултифункционалност е лизил tRNA синтетаза, ензим од класата на аминоацил tRNA синтетази, кој не само што го приложува остатокот од лизин на tRNA, туку го регулира и транскрипцијата на неколку гени. Протеините вршат многу функции заради нивната ензимска активност. Значи, ензимите се протеини од миозин мотор, регулаторни протеини кинази протеини, транспорт протеини натриум-калиум аденозин трифосфатаза, итн.

Каталитичка функција
Најпознатата функција на протеините во организмот е катализацијата на разни хемиски реакции. Ензимите се протеини кои имаат специфични каталитички својства, односно секој ензим ја катализира една или повеќе слични реакции. Ензимите го катализираат разделувањето на комплексни молекули (катаболизам) и нивната синтеза (анаболизам), вклучително и ДНК репликација и поправка и синтеза на РНТ-матрица. До 2013 година се опишани повеќе од 5.000 ензими. Забрзувањето на реакцијата како резултат на ензимската катализа може да биде огромно: реакцијата катализирана од ензимот оротидин-5'-фосфат декарбоксилаза, на пример, продолжува 10 17 пати побрзо од не-катализираната (полуживотот на декарбоксилацијата на оротската киселина е 78 милиони години без ензимот 18) Молекулите што се приврзуваат на ензимот и се менуваат како резултат на реакцијата се нарекуваат подлоги.
Иако ензимите обично се состојат од стотици остатоци на аминокиселини, само мал дел од нив комуницираат со подлогата, па дури и помали количини - во просек 3-4 остатоци од аминокиселини, честопати лоцирани далеку едни од други во примарната структура - се директно вклучени во катализата. Делот од молекулата на ензимот што обезбедува врзување на подлогата и катализата се нарекува активен центар.
Во 1992 година, Меѓународната унија за биохемија и молекуларна биологија ја предложи конечната верзија на хиерархиската номенклатура на ензимите врз основа на видот на реакции, катализирани од нив. Според оваа номенклатура, имињата на ензимите секогаш мора да имаат крај -основите и формираат од имињата на катализираните реакции и нивните подлоги. На секој ензим му се доделува индивидуален код со кој лесно може да се одреди нејзината позиција во хиерархијата на ензимите.Според видот на катализираните реакции, сите ензими се поделени во 6 класи:
- CF 1: оксидоредуктази кои ги катализираат реакциите на редокс,
- CF 2: Трансферази кои го катализираат трансферот на хемиски групи од еден молекул на подлогата во друга,
- CF 3: Хидролазите ја катализираат хидролизата на хемиските врски,
- CF 4: Лијази кои го катализираат кршењето на хемиските врски без хидролиза со формирање на двојна врска во еден од производите,
- CF 5: Изомерази кои ги катализираат структурните или геометриските промени во молекулот на подлогата,
- CF 6: Лигази кои го катализираат формирањето на хемиски врски помеѓу подлоги како резултат на хидролиза на ATP дифосфатната врска или сличен трифосфат.
Структурна функција
Структурните протеини на цитоскелетот, како еден вид арматура, облик на клетки и многу органоиди и се вклучени во промена на обликот на клетките. Повеќето структурни протеини се филаментозни: мономите на актин и тубулин се, на пример, глобуларни, растворливи протеини, но по полимеризација тие формираат долги нишки што го сочинуваат цитоскелетот, што му овозможува на клетката да одржува форма. Колагенот и еластинот се главните компоненти на меѓуклеточната супстанција на сврзното ткиво (на пример, 'рскавицата), а косата, ноктите, птичјите пердуви и некои школки се составени од друг структурен протеин на кератин.

Заштитна функција
Постојат неколку видови на заштитни функции на протеини:
- Физичка заштита. Физичката заштита на телото е обезбедена со колаген, протеин кој ја формира основата на меѓуклеточната супстанција на сврзните ткива (вклучувајќи коски, 'рскавица, тетиви и длабоки слоеви на кожата (дермисот)), кератин, кој претставува основа на роговиден штит, коса, пердуви, рогови и други деривати на епидермисот. Обично, ваквите протеини се сметаат како протеини со структурна функција. Примери на протеини од оваа група се фибриноген и тромбин вклучени во коагулацијата на крвта.
- Хемиска заштита. Поврзувањето на токсините со молекулите на протеините може да обезбеди нивна детоксикација. Особено важна улога во детоксикацијата кај луѓето играат ензимите на црниот дроб кои ги разложуваат отровите или ги претвораат во растворлива форма, што придонесува за нивна брза елиминација од телото.
- Имунолошка одбрана. Протеините кои сочинуваат крв и други течности од телото се вклучени во одбраната на телото како одговор и на оштетување и на напад на патогени. Протеините на системот за надополнување и антителата (имуноглобулини) припаѓаат на протеините од втората група, тие ги неутрализираат бактериите, вирусите или странските протеини. Антитела кои се дел од адаптивниот имунолошки систем, се приврзуваат на супстанции кои се туѓи за организмот, антигени, а со тоа ги неутрализираат, насочувајќи ги кон местата на уништување. Антителата можат да се лачат во меѓуклеточниот простор или да се фиксираат во мембраните на специјализираните Б-лимфоцити наречени плазмоцити.
Регулаторна функција
Многу процеси во внатрешноста на клетките се регулираат со протеински молекули, кои не се ниту извор на енергија, ниту градежен материјал за клетката. Овие протеини го регулираат напредокот на клетките во клеточен циклус, транскрипција, превод, спојување, активност на други протеини и многу други процеси. Протеините ја вршат регулаторната функција или заради ензимска активност (на пример, протеински кинази), или заради специфично врзување за другите молекули. Така, факторите на транскрипција, активирачките протеини и протеините на репресорот, можат да го регулираат интензитетот на транскрипција на гените со врзување за нивните регулаторни секвенци. На ниво на превод, читањето на многу mRNAs е исто така регулирано со додавање на протеински фактори.
Најважната улога во регулирањето на интрацелуларните процеси ја играат протеинските кинази и протеински фосфатази - ензими кои ја активираат или ја инхибираат активноста на другите протеини со приложување на нив или раздвојување на фосфатните групи.

Функција на сигнал
Функцијата на сигналот на протеините е способноста на протеините да служат како сигнални супстанции, пренесувајќи сигнали помеѓу клетките, ткивата, органите и организмите. Честопати, функцијата на сигналот е комбинирана со регулаторната, бидејќи многу интрацелуларни регулаторни протеини исто така пренесуваат сигнали.
Функцијата за сигнализација ја вршат хормонски протеини, цитокини, фактори на раст, итн.
Хормоните се носат со крв. Повеќето животински хормони се протеини или пептиди. Поврзувањето на хормонот со неговиот рецептор е сигнал што предизвикува одговор на клетките. Хормоните ја регулираат концентрацијата на супстанциите во крвта и клетките, растот, репродукцијата и другите процеси. Пример за вакви протеини е инсулин, кој ја регулира концентрацијата на гликоза во крвта.
Клетките комуницираат едни со други со помош на сигнални протеини кои се пренесуваат преку меѓуклеточната супстанција. Таквите протеини вклучуваат, на пример, цитокини и фактори на раст.
Цитокините се молекули на сигнализација на пептид. Тие ги регулираат интеракциите помеѓу клетките, го одредуваат нивниот опстанок, го стимулираат или инхибираат растот, диференцијацијата, функционалната активност и апоптозата, обезбедуваат координација на имунитетот, ендокриниот и нервниот систем. Пример за цитокини е факторот на некроза на туморот, кој пренесува воспалителни сигнали помеѓу клетките на телото.
Функција за резервни (чекање)
Таквите протеини вклучуваат таканаречени резервни протеини, кои се чуваат како извор на енергија и супстанција во семето на растенијата (на пример, глобулини 7S и 11S) и животински јајца. Голем број на други протеини се користат во организмот како извор на аминокиселини, кои, пак, се претходници на биолошки активни супстанции кои ги регулираат метаболичките процеси.

Функција на рецептор
Протеинските рецептори можат да бидат лоцирани и во цитоплазмата и да се интегрираат во клеточната мембрана. Еден дел од молекулата на рецепторот прима сигнал, на кој најчесто им служи хемиска супстанција, а во некои случаи - лесен, механички стрес (на пример, истегнување) и други стимули. Кога сигналот е изложен на одреден дел од молекулата - протеинот на рецепторот - се случуваат нејзините конформациски промени. Како резултат, се менува конформацијата на друг дел од молекулот, кој пренесува сигнал на други клеточни компоненти. Постојат неколку механизми за пренесување на сигнали. Некои рецептори ја катализираат одредена хемиска реакција, други служат како јонски канали, кои се отвораат или се затвораат со дејството на сигналот, додека други специјално ги врзуваат молекулите со посредство на меѓуклеточните. Кај мембранските рецептори, делот од молекулот што се врзува за молекулот на сигналот е на површината на клетката, а доменот што го пренесува сигналот е внатре.
Функција на мотор (мотор)
Цела класа на моторни протеини обезбедува движења на телото, на пример, мускулна контракција, вклучително и локомотивност (миозин), движење на клетки во телото (на пример, амебоидно движење на леукоцити), движење на цилија и флагела, како и активен и насочен меѓуклеточен транспорт (кинезин, динеин) . Диените и кинезините ги транспортираат молекулите долж микротубулите со употреба на АТП хидролиза како извор на енергија. Динините ги пренесуваат молекулите и органелите од периферните делови на клетката кон центрозомот, кинезините - во спротивна насока. Dyneins се исто така одговорни за движење на цилија и флагела на еукариотите. Цитоплазматските варијанти на миозин можат да бидат вклучени во транспортот на молекули и органоиди преку микрофиламенти.
Протеини во метаболизмот
Повеќето микроорганизми и растенија можат да синтетизираат 20 стандардни аминокиселини, како и дополнителни (нестандардни) аминокиселини, како што е цитрулин.Но, ако аминокиселините постојат во околината, дури и микроорганизмите заштедуваат енергија со транспортирање на аминокиселини во клетките и исклучување на нивните биосинтетички патишта.
Аминокиселините кои не можат да се синтетизираат од животните се нарекуваат суштински. Главните ензими во биосинтетичките патеки, на пример, аспартат киназа, што го катализира првиот чекор во формирањето на лизин, метионин и треонин од аспарат, се отсутни кај животните.
Animивотните главно добиваат аминокиселини од протеините кои се наоѓаат во храната. Протеините се уништуваат за време на варењето, што обично започнува со денатурирање на протеините со ставање во кисела средина и хидролизирање на истиот со употреба на ензими наречени протеази. Некои аминокиселини добиени како резултат на варењето се користат за синтетизирање на протеините во телото, додека останатите се претвораат во гликоза за време на глуконеогенезата или се користат во циклусот Кребс. Употребата на протеини како извор на енергија е особено важна во услови на постот, кога сопствените протеини на телото, особено мускулите, служат како извор на енергија. Аминокиселините се исто така важен извор на азот во исхраната на организмот.
Нема унифицирани стандарди за внес на протеини во човекот. Микрофлората на големото црево синтетизира аминокиселини кои не се земени предвид при подготовката на протеинските норми.
Методи на студии
Структурата и функциите на протеините се изучуваат и на прочистени препарати ин витрои во нивната природна средина во жив организам, ин виво. Студиите за чисти протеини под контролирани услови се корисни за одредување на нивните функции: кинетички карактеристики на каталитичката активност на ензимите, релативна афинитет за разни подлоги, итн. Протеини студии ин виво во клетките или во цели организми обезбедуваат дополнителни информации за тоа каде тие функционираат и како е регулирана нивната активност.
Молекуларна и клеточна биологија

Молекуларните и клеточните биолошки методи најчесто се користат за проучување на синтезата и локализацијата на протеините во клетка. Широко се користи метод за проучување на локализацијата, заснован на синтеза на химеричен протеин во клетка, што се состои од проучуваниот протеин, поврзан со „известувач“, на пример, зелен флуоресцентен протеин (GFP). Локацијата на таков протеин во ќелијата може да се види со помош на флуоресцентен микроскоп. Покрај тоа, протеините можат да бидат визуелизирани со употреба на антитела кои ги препознаваат, кои за возврат носат флуоресцентна етикета. Честопати, истовремено со проучуваниот протеин, се визуелизираат често познати протеини на такви органели како ендоплазматски ретикулум, Golgi апарат, лизозоми и вакуоли, што овозможува попрецизно утврдување на локализацијата на проучуваниот протеин.
Имунохистохемиските методи обично користат антитела кои се конјугираат на ензими кои го катализираат формирањето на луминисцентен или обоен производ, што ви овозможува да ја споредите локализацијата и количината на протеини што се изучуваат во примероците. Поретка техника за утврдување на локацијата на протеините е рамнотежната ултрацентрифугирање на фракциите на клетките во градиентот на сахароза или цезиум хлорид.
Конечно, една од класичните методи е имуноелектронска микроскопија, која е фундаментално слична на микроскопија на имунофлуоресценција со таа разлика што се користи електронски микроскоп. Примерокот е подготвен за електронска микроскопија, а потоа се обработува со антитела на протеин, кои се поврзани со електронски густ материјал, обично злато.
Користејќи мутагенеза насочена кон страницата, истражувачите можат да ја променат низата на аминокиселините на протеинот и, следствено, нејзината просторна структура, локацијата во клетката и регулирањето на неговата активност. Користејќи го овој метод, користејќи модифицирани tRNA, може да се воведат и вештачки аминокиселини во протеин и да се конструираат протеини со нови својства.
Биохемиски
Да се изврши анализа ин витро протеинот мора да се прочисти од други клеточни компоненти. Овој процес обично започнува со уништување на клетките и добивање на т.н. екстракт од клетки. Понатаму, со методите на центрифугирање и ултрацентрифугирање, овој екстракт може да се подели на: фракција што содржи растворливи протеини, фракција која содржи мембрани на липиди и протеини и фракција која содржи клеточни органели и нуклеински киселини.

Врнежите со протеини со солење се користат за одделување на протеински мешавини, а исто така се овозможува концентрација на протеини. Анализата на седиментација (центрифугирање) ви овозможува да ги фракционирате протеинските мешавини според вредноста на постојаната таложечка количина на индивидуалните протеини, измерени во svedbergs (S). Различни видови на хроматографија потоа се користат за изолирање на посакуваниот протеин или протеини врз основа на својства како што се молекуларна тежина, полнење и афинитет. Покрај тоа, протеините можат да бидат изолирани според нивното полнење со користење на електрофокус.
За да се поедностави процесот на прочистување на протеините, често се користи генетско инженерство, што ви овозможува да создадете деривати на протеини кои се погодни за прочистување, без да влијаат на нивната структура или активност. „Етикети“, кои се мали низи на аминокиселини, на пример, ланец од 6 или повеќе остатоци на хистидин и се прикачени на едниот крај на протеинот. Кога екстрактот од клетките што ја синтетизираат „обележаната“ протеин, се пренесува преку хроматографска колона во која има јони на никел, хистидинот се врзува со никел и останува на колоната, додека преостанатите компоненти на лисатот поминуваат низ колоната непречена (никел-хелатна хроматографија). Многу други етикети се дизајнирани да им помогнат на истражувачите да изолираат специфични протеини од сложени мешавини, најчесто користејќи хроматографија на афинитет.
Степенот на прочистување на протеините може да се утврди дали се познати неговата молекуларна тежина и изоелектричната точка - користејќи различни типови гел електрофореза - или со мерење на ензимска активност ако протеинот е ензим. Масената спектрометрија ви овозможува да го идентификувате избраниот протеин според неговата молекуларна тежина и масата на неговите фрагменти.
Протеомика
Целокупноста на клеточните протеини се нарекува протеом, нејзина студија - протеомика, наречена по аналогија со геномика. Клучните експериментални протеомички методи вклучуваат:
- 2Д електрофореза, која овозможува раздвојување на повеќекомпонентни мешавини на протеини,
- масена спектрометрија, која овозможува идентификување на протеините според масата на нивните составни пептиди со висок проток,
- протеински микрорези, кои ви овозможуваат истовремено да ја измерите содржината на голем број протеини во клетката,
- дво-хибриден систем на квасец , што ви овозможува систематски да ги проучувате интеракциите меѓу протеините и протеините.
Целокупноста на сите биолошки значајни интеракции на протеините во клетка се нарекува интерактом. Систематска студија за структурата на протеините што ги претставуваат сите можни типови на терциерни структури се нарекува структурна геномика.
Предвидување на структурата и моделирање
Предвидување на просторна структура со користење на компјутерски програми (во силициум) овозможува изградба на протеини модели чија структура сè уште не е утврдена експериментално. Најуспешниот вид на предвидување на структурата, познат како хомологно моделирање, се потпира на постојната структура „образец“, слична во аминокиселинската секвенца со моделираниот протеин. Методите за предвидување на просторната структура на протеините се користат во областа на развој на генетско инженерство на протеините, со помош на кои веќе се добиени нови терциерни структури на протеини. Покомплексна компјутерска задача е предвидување на меѓумолекуларни интеракции, како што се молекуларно докинг и предвидување на интеракции протеини-протеини.
Преклопните и меѓумолекуларните интеракции на протеините можат да се моделираат со употреба на молекуларна механика. , особено, молекуларната динамика и методот Монте Карло, кои сè повеќе ја искористуваат паралелната и дистрибуираната пресметка (на пример, проектот Folding @ home).Преклопувањето на мали а-спирални протеински домени, како што се протеини од вилин или еден од ХИВ протеините, е успешно моделирано во силициум. Користејќи хибридни методи кои комбинираат стандардна молекуларна динамика со квантната механика, истражени се електронските состојби на визуелниот пигмент родопсин.