Биосинтеза на холестерол и неговата биохемија - Дијабетес
Без сомнение, холестеролот е најпознат липид за пошироката јавност, тој е познат поради високата корелација помеѓу високиот холестерол во крвта и зачестеноста на кардиоваскуларните заболувања кај луѓето. Помалку внимание е посветено на клучната улога на холестеролот како компонента на клеточните мембрани и како претходник на стероидните хормони и жолчните киселини. Холестеролот е неопходен за многу животни, вклучително и луѓето, но неговото присуство во храна за цицачи е незадолжително - самите клетки на телото можат да го синтетизираат од едноставни претходници.
Структурата на ова соединение од 27 јаглерод сугерира комплексна патека за нејзина биосинтеза, но сите негови атоми на јаглерод се обезбедени од еден претходник - ацетат. Изопренови блокови - најважните посредници од ацетат до холестерол, тие се прекурсори на многу природни липиди, а механизмите со кои се полимеризираат блокови на изопрена се слични на сите метаболички патеки.
Започнуваме со испитување на главните фази на патот на биосинтезата на холестерол од ацетат, потоа разговараме за транспортот на холестерол низ крвотокот, неговата апсорпција од страна на клетките, нормално регулирање на синтезата на холестерол и регулирање во случаи на нарушена апсорпција или транспорт. Потоа, гледаме на други супстанции кои потекнуваат од холестерол, како што се жолчните киселини и стероидните хормони. Конечно, описот на биосинтетичките патеки за формирање на многу соединенија - деривати на изопенски блокови, во кои има вообичаени рани фази со синтеза на холестерол, ќе ја илустрира извонредната разноврсност на кондензацијата на изопреноид во биосинтезата.
Холестеролот се произведува од ацетил-CoA во четири фази
Холестеролот, како и масните киселини со долг ланец, е направен од ацетил-CoA, но моделот на склопување е сосема различен. Во првите експерименти, ацетат обележан со 14 C или на метил или карбоксил јаглероден атом е додаден на добиточна храна. Врз основа на дистрибуцијата на етикетата во холестерол изолирана од две групи на животни (Сл. 21-32), беа опишани ензимските фази на биосинтезата на холестерол.
Сл. 21-32. Извор на јаглеродни атоми на холестерол. Идентификувани за време на експериментите со употреба на радиоактивен ацетат обележани со метил карбон (црна) или карбоксил јаглерод (црвена). Во кондензирана структура, прстените се означуваат со буквите А до Д.

Синтезата се одвива во четири фази, како што е прикажано на сл. 21-33: (1) кондензација на три остатоци од ацетат за да се формира шест-јаглероден посредник на мевалонат, (2) конверзија на мевалонат во активирани изопрени блокови, (3) полимеризација на шест единици со пет јаглеродни изопрени за формирање на 30-јаглероден линеарен сквален, (4) циклирање на сквален во форма четири прстени на стероидното јадро, проследено со низа промени (оксидација, отстранување или миграција на метил групи) со формирање на холестерол.
Сл. 21-33. Генерализирана слика за биосинтезата на холестерол. Четири фази на синтеза се дискутирани во текстот. Изопренските блокови во сквален се обележани со црвени испрекинати линии.

Сцена (1) Синтеза на мевалонат од ацетат. Првата фаза на биосинтезата на холестерол доведува до формирање на среден производ мевалонираат (Сл. 21-34). Двете молекули на ацетил CoA се кондензираат за да се даде ацетоцетил CoA, кој се кондензира со третиот молекул на ацетил CoA за да формира соединение од шест јаглерод β-хидрокси-β-метилгутарил-CoA (HM G-CoA). Овие две први реакции се катализирани тиолаза и NM G-CoA синтеза, соодветно. Цитосолен NM G-CoA синтеза Овој метаболички пат се разликува од митохондрискиот изоензим, кој ја катализира синтезата на NM G-CoA за време на формирањето на кетонските тела (види слика 17-18).
Сл. 21-34. Формирање на мевалонат од ацетил-CoA. Изворот на C-1 и C-2 мевалонат од ацетил-CoA е истакнат во розова боја.

Третата реакција ја ограничува брзината на целиот процес. Во него, NM G-CoA се сведува на мевалонат, за што секоја од двете NA D PH молекули обезбедува два електрони. HMG-CoA редуктаза - интегрален мембрана протеин на мазен ER, служи, како што ќе видиме подоцна, како главна точка за регулирање на метаболичкиот пат на формирање на холестерол.
Фаза (2). Претворањето на мевалонатот во две активирани изопрени. Во следната фаза на синтеза на холестерол, три фосфатни групи се префрлаат од молекули на АТП во мевалонат (Сл. 21-35). Фосфатот врзан за хидроксил групата кај Ц-3 мевалонат во средно 3-фосфо-5-пирофосфомевалонат е добра заминувачка група, во следниот чекор и од овие фосфати и од соседната карбоксилна група заминуваат, формирајќи двојна врска во производот од пет јаглерод ∆ 3 -изопентенил пирофосфат. Ова е прва од двете активирани изопрени - главните учесници во синтезата на холестерол. Изомеризација на Δ3-изопентенилпирофосфат дава втора активирана изоопрена диметилално пирофосфат. Синтезата на изопентенил пирофосфат во цитоплазмата на растителните клетки се јавува според патеката опишана овде. Сепак, растителните хлоропласти и многу бактерии користат патека независна од мевалонат. Овој алтернативен пат не се наоѓа кај животни, затоа е привлечен при креирање нови антибиотици.
Сл. 21-35. Конверзија на mevalonate во активирани блокови на изоопрена. Шесте активирани единици се комбинираат за да формираат сквален (види слика 21-36). Останатите групи на 3-фосфо-5-пирофосфомевалонат се означени со розова боја. Во квадратни загради е хипотетички средно.

Фаза (3). Кондензација на шест активирани изопренски единици за формирање на сквален. Изопентенил пирофосфат и диметилалил пирофосфат сега се подложени на кондензација од глава до опашка, во која се движи една група пирофосфат и се формира синџир од 10-јаглерод - геранилен пирофосфат (Сл. 21-36). (Пирофосфат му се закачува на главата.) Геранил пирофосфат се подложува на следната кондензација од глава до опашка со изопентентил пирофосфат и 15-јаглероден посредник фарнизил пирофосфат. Конечно, двете молекули на фарнезил пирофосфат се комбинираат „глава до глава“, и двете фосфатни групи се отстранети - формирани сквален.
Сл. 21-36. Формирање на сквален. Сквална структура која содржи 30 јаглеродни атоми се јавува за време на последователни кондензации активирани од блокови изоопрен (пет-јаглерод).

Заедничките имиња за овие посредници потекнуваат од имињата на изворите од кои прво биле изолирани. Геранинол, компонента на маслото од роза, има вкус на гераниум, а фарнесолот, кој се наоѓа во боите на багремот фарнаса, има крин од аромата на долината. Многу природни мириси на растенија припаѓаат на соединенија изградени од блокови на изоопрена. Сквален, прв изолиран од црн дроб од ајкула (видови на Сквалус), се состои од 30 атоми на јаглерод: 24 атоми во главниот ланец и шест атоми во металните супституенти.
Фаза (4). Трансформација на сквален во четири прстени на стероидното јадро. На сл. 21-37 јасно се гледа дека структурата на синџирот на сквален, а стеролите - циклични. Сите стероли имаат четири кондензирани прстени кои го формираат стероидното јадро, а сите нив се алкохоли со хидроксилна група на атомот Ц-3, па оттука и англиското име стерол. Под акција сквален моноксигеназа еден атом на кислород од О се додава на крајот на синџирот на сквален 2 и се формира епоксид. Овој ензим е уште еден оксидаза со мешана функција (додадете 21-1), NADPH намалува друг атом на кислород од O 2 до Н2 О. Двојни врски за производи сквален-2,3-епоксид наредени така што неверојатно конзистентна реакција може да претвори ланец на сквален епоксид во циклична структура. Во клетките на животните, оваа циклизација доведува до формирање на ланостерол која содржи четири прстени карактеристични за стероидното јадро. Како резултат, ланостеролот се претвора во холестерол преку серија од приближно 20 реакции, што вклучува и миграција на некои метални групи и отстранување на други. Описот на овој неверојатен пат на биосинтеза, еден од најтешките меѓу познатите, го направиле Конрад Блох, Теодор Лин, Johnон Корнфорт и Georgeорџ Попиак кон крајот на 50-тите години на минатиот век.
Сл. 21-37. Затворањето на прстенот го претвора линеалниот сквален во кондензирано стероидно јадро. Првата фаза се катализира со оксидаза со мешана функција (моноксигеназа), чиј косбстрат е N AD PH. Производот е епоксид, кој во следната фаза циклусира за да формира стероидно јадро. Крајниот производ на овие реакции кај клетките на животните е холестерол, во други организми се формираат стероли малку различни од него.


Холестеролот е стерол карактеристичен за животинските клетки, растенија, габи и протеини произведуваат други многу слични стероли.
Тие користат ист пат на синтеза до сквален-2,3-епоксид, но потоа патеките се разминуваат малку, а се формираат и други стероли, како што се сигмастерол кај многу растенија и ергостерол кај габи (Сл. 21-37).
Пример 21-1 Трошоци за енергија за синтеза на сквален
Кои се трошоците за енергија (изразени како АТП молекули) за синтеза на една молекула на сквален?
Решение Во синтезата на сквален од ацетил-CoA, АТП се троши само во фазата кога мевалонатот се претвора во активиран претходник на сквален на активирана изоопрена. За да се изгради молекула на сквален, потребни се шест активирани молекули на изопрена, а потребни се три молекули на АТП за производство на секоја активирана молекула. Вкупно, 18 АТП молекули се потрошени на синтеза на еден молекул на сквален.
Соединенија на холестерол во организмот
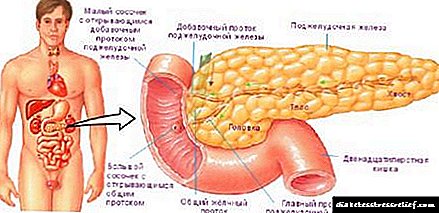
Кај 'рбетниците, големи количини на холестерол се синтетизираат во црниот дроб. Дел од холестеролот синтетизиран таму е инкорпориран во мембраните на хепатоцитите, но тој главно се извезува во една од трите форми: билијарна (жолчката) холестерол, жолчни киселини или хостери на холестерол. Bолчни киселини а нивните соли се хидрофилни деривати на холестерол, кои се синтетизираат во црниот дроб и придонесуваат за варење на липидите (види слика 17-1). Естри на холестерол формирана во црниот дроб со акција ацил-CoA-холестерол-ацилтрансфераза (ACAT). Овој ензим го катализира трансферот на остатоци од масни киселини од коензим А во хидроксилна група на холестерол (Сл. 21-38), претворајќи го холестеролот во повеќе хидрофобна форма. Хостери на холестерол во секретираните честички на липопротеини се транспортираат во други ткива со помош на холестерол или се чуваат во црниот дроб.
Сл. 21-38. Синтеза на хостери на холестерол. Етерификацијата го прави холестеролот уште повеќе хидрофобна форма за чување и транспорт.

Холестеролот е неопходен за сите ткива на растечки животински организам за синтеза на мембрани, а некои органи (на пример, надбубрежните жлезди и половите жлезди) користат холестерол како претходник на стероидните хормони (ова ќе се дискутира подолу). Холестеролот е исто така претходник на витамин Д (види слика 10-20, с. 1).
Холестеролот и другите липиди носат липопротеини во плазма
Естери на холестерол и холестерол, како триацилглицероли и фосфолипиди, практично се нерастворливи во вода, сепак, тие мора да се движат од ткивото во кое се синтетизирале до ткивата каде што ќе се чуваат или трошат. Тие се носат од крвотокот во форма на липопротеини во крвната плазма - макромолекуларни комплекси на специфични протеини на носачи (аполипротеини) со фосфолипиди, холестерол, холестерол естери и триацилглицероли присутни во овие комплекси во различни комбинации.
Аполипропротеините („апо“ се однесува на самиот липид протеин) се комбинираат со липиди за да формираат неколку фракции на честички на липопротеини - сферични комплекси со хидрофобни липиди во центарот и синџири на хидрофилни аминокиселини на површината (Сл. 21-39, а). Со различни комбинации на липиди и протеини, се формираат честички со различна густина - од хиломикрони до липопротеини со висока густина. Овие честички можат да бидат одделени со ултрацентрифугирање (Табела 21-1) и визуелно да се набудуваат со помош на електронска микроскопија (слика 21-39, б). Секоја фракција липопротеини врши специфична функција, која е одредена од местото на синтеза, липиден состав и содржина на аполипропротеини. Најмалку 10 различни аполипротеини се пронајдени во човечката крвна плазма (Табела 21-2), кои варираат по големина, реакции со специфични антитела и карактеристична дистрибуција во различни класи на липопротеини. Овие протеински компоненти делуваат како сигнални супстанции кои ги насочуваат липопротеините кон специфични ткива или ги активираат ензимите кои делуваат на липопротеините.
Табела 21-1. Човечки плазма липопротеини
Состав (маса,%)
r = 513,000). Една честичка од ЛДЛ содржи јадро од приближно 1.500 молекули на холестерол естери, околу јадрото има лушпа од 500 молекули холестерол, 800 молекули фосфолипиди и една молекула на apoB-100. б - четири класи липопротеини, видливи со електронски микроскоп (по манифестација на негативни). Во насока на стрелките на часовникот, почнувајќи од горната лева фигура: хиломикрони - со дијаметар од 50 до 200 nm, PL O NP - од 28 до 70 nm, HDL - од 8 до 11 nm, а LDL - од 20 до 55 nm. Карактеристиките на липопротеините се дадени во табелата. 21-2.

Хиломикрони, наведен во Сек. 17, преместете ги триацилглицеролите со храна од цревата во другите ткива. Овие се најголемите липопротеини, тие имаат најмала густина и најголема релативна содржина на триацилглицероли (види Сл. 17-2). Хиломикроните се синтетизираат во ЕР на епителните клетки што ја обложуваат тенкото црево, а потоа се движат низ лимфниот систем и влегуваат во крвотокот низ левата субклавијална вена. Аполипопротеините со хиломикрон содржат апоБ-48 (уникатен за оваа класа липопротеини), аОЕ и аПО-II (Табела 21-2). AroC-II ја активира липопротеинската липаза во капиларите на масното ткиво, срцето, скелетните мускули и млечната млечна жлезда, обезбедувајќи проток на слободни масни киселини во овие ткива. Така, хиломикроните пренесуваат храна масни киселини во ткива, каде што ќе се консумираат или чуваат како гориво (Сл. 21-40). Остатоците од хиломикрон (главно ослободени од триацилглицероли, но сепак содржат холестерол, apoE и apoB-48) се транспортираат преку крвотокот до црниот дроб. Во црниот дроб, рецепторите се врзуваат за аОЕ содржани во остатоци од хиломикрон и ја посредуваат нивната апсорпција со ендоцитоза. Кај хепатоцитите овие остатоци го ослободуваат холестеролот што го содржат и се уништуваат во лизозомите.
Табела 21-2. Аполипопротеини со липопротеини во плазма на човекот
Функција (ако е позната)
Активира L CAT, комуницира со транспортерот ABC
Инхибира L CAT
Активира L CAT, транспорт / дозвола за холестерол
Врзи на LDL рецепторот
Хиломикрони, VLDL, HDL
Хиломикрони, VLDL, HDL
Хиломикрони, VLDL, HDL
Започнува дозвола за остатоци од VLDL и хиломикрон
Кога храната содржи повеќе масни киселини отколку што моментално може да се користат како гориво, тие се претвораат во триацилглицероли во црниот дроб, кои формираат дел со специфични аполипротеини липопротеини со мала густина (VLDL). Прекумерните јаглехидрати во црниот дроб, исто така, можат да се претворат во триацилглицероли и да се извезуваат како VLDL (Сл. 21-40, а).Покрај триацилглицероли, фракцијата VLDL содржи одредена количина на естери на холестерол и холестерол, како и аОБ-100, амоЦ-1, аОС-II, аОЦ III и аПЕ (Табела 21-2). Овие липопротеини исто така се транспортираат со крв од црниот дроб во мускулите и масното ткиво, каде што откако ќе се активира липопротеината липаза со апо-Ц II, бесплатните масни киселини се ослободуваат од триацилглицероли на фракцијата VLDL. Адипоцитите фаќаат слободни масни киселини, повторно ги претвораат во триацилглицероли, кои се чуваат во овие клетки во форма на липидни подмножества (капки), миоцитите, напротив, веднаш ги оксидираат масните киселини со цел да создадат енергија. Повеќето остатоци од VLDL се елиминираат од циркулацијата со хепатоцитите. Нивната апсорпција, слична на апсорпцијата на хиломикрони, е посредувана од рецептори и зависи од присуството на аОЕ во остатоци од VLDL (во додаток 21-2, опишана е врската помеѓу аПЕ и Алцхајмеровата болест).
Сл. 21-40. Липопротеини и липиди транспорт, и - липидите се транспортираат преку крвотокот во форма на липопротеини, кои се комбинираат во неколку фракции со различни функции и различен состав на протеини и липиди (таб. 21-1, 21-2) и одговара на густината на овие фракции. Липидите за храна се агрегираат во хиломикрони, повеќето од триацилглицеролите содржани во нив се ослободуваат со липопротеинска липаза во масно и мускулно ткиво во капиларите. Остатоците од хиломикрон (кои содржат главно протеини и холестерол) се заробени од хепатоцитите. Ендогени липиди и холестерол од црниот дроб се доставуваат до масното и мускулното ткиво во форма на VLDL. Ослободувањето на липидите од VLDL (заедно со губење на некои аполипропротеини) постепено го претвора VLDLP во LDL, што го испорачува холестеролот во екстрахепатични ткива или го враќа на црниот дроб. Црниот дроб ги доловува остатоците од VLDL, LDL и остатоците од хиломикрони со ендоцитоза посредувана од рецептор. Вишокот холестерол во екстрахепатичните ткива се транспортира назад во црниот дроб во форма на ЛДЛ. Во црниот дроб, дел од холестеролот се претвора во жолчни соли. б - примероци во плазма во крвта земени по глад (лево) и после јадење храна со висока содржина на маснотии (десно). Хиломикроните формирани со јадење масна храна му даваат на плазмата надворешна сличност со млекото.

Со губење на триацилглицероли, дел од VLDL се претвора во остатоци од VLDL, исто така наречени липопротеини со средна густина (VLDL), што дополнително отстранување на триацилглицероли од VLDL дава липопротеини со мала густина (LDL) (таб. 21-1). Фракцијата LDL, која е многу богата со хостери на холестерол и холестерол, а исто така содржи апоБ-100, го пренесува холестеролот во екстрахепатични ткива кои носат специфични рецептори кои препознаваат apoB-100 на нивните плазма мембрани. Овие рецептори посредуваат во внесувањето холестерол и хостери на холестерол (како што е опишано подолу).
Додаток 21-2.Алолите на ApoE ја одредуваат инциденцата на Алцхајмерова болест
Кај човечкото население постојат три познати варијанти (три алели) на генот кој го кодираат аполипропротеинот Е. од алелите АПЕЕ, алелот АПОЕЗ е најчест кај луѓето (околу 78%), алелите АПОЕ4 и АПОЕ2 се 15 и 7%, соодветно. Алелот APOE4 е особено карактеристичен за лицата со Алцхајмерова болест, а оваа врска овозможува предвидување на појавата на болеста со голема веројатност. Луѓето кои наследиле АПОЕ4 имаат висок ризик од развој на доцна Алцхајмерова болест. Луѓето хомозиготни за АПОЕ4 имаат 16 пати поголема веројатност за развој на болеста, просечната возраст на оние што се разболуваат е околу 70 години. За луѓето кои наследуваат две примероци на АРОЕЗ, напротив, просечната возраст на Алцхајмерова болест надминува 90 години.
Молекуларната основа за поврзаност помеѓу апоЕ4 и Алцхајмерова болест е сè уште непозната. Покрај тоа, сè уште е нејасно како аОЕ4 може да влијае на растот на амилоидните жици, кои очигледно се основната причина за Алцхајмеровата болест (види Сл. 4-31, с. 1). Претпоставките се фокусираат на можната улога на apoE во стабилизирање на структурата на цитоскетот на невроните. Протеините apoE2 и apoEZ се врзуваат за голем број протеини поврзани со микротубули на неврони, додека apoE4 не се врзува. Ова може да ја забрза смртта на невроните. Без оглед на што може да испадне овој механизам, овие набудувања даваат надеж за проширување на нашето разбирање за биолошките функции на аполипротеините.
Четвртиот вид липопротеини - липопротеини со висока густина (HDL), оваа фракција е формирана во црниот дроб и тенкото црево во форма на мали честички богати со протеини кои содржат релативно малку холестерол и целосно ослободени од естери на холестерол (Сл. 21-40). HDL-фракцијата содржи apoA-I, apoC-I, apoC-II и други аполипропротеини (Табела 21-2), како и лецитин-холестерол-ацилтрансфераза (LC AT), што го катализира формирањето на холестерол естери од лецитин (фосфатидилхолин) и холестерол (Сл. 21-41). L CAT на површината на новоформираните HDL честички го претвора холомикронскиот холестерол и фосфатидилхолин и VLDL остатоци во холестерол естери, кои почнуваат да го формираат јадрото, трансформирајќи ги новоформираните дискоидни HDL честички во зрели сферични HDL честички. Овој липопротеин богат со холестерол се враќа во црниот дроб, каде холестеролот се „испразнува“, дел од овој холестерол се претвора во жолчни соли.
Сл. 21-41. Реакцијата катализирана од лецитин-холестерол-ацилтрансфераза (L CAT). Овој ензим е присутен на површината на HDL честичките и се активира со апоА-1 (компонента на HDL фракцијата). Естери на холестерол се акумулираат во новоформираните честички на ХДЛ, претворајќи ги во зрели HDL.

HDL може да се апсорбира во црниот дроб со ендоцитоза посредувана од рецептор, но барем дел од HDL холестеролот се испорачува на други ткива со други механизми. HDL честичките можат да се врзуваат за протеините на SR - BI рецепторот на плазма мембраната на клетките на црниот дроб и во стероидногено ткиво како што се надбубрежните жлезди. Овие рецептори не посредуваат во ендоцитоза, туку делумно и селективно пренесување на холестерол и други липиди на HDL фракцијата во клетката. „Исцрпената“ HDL фракција повторно влегува во крвотокот, каде вклучува нови делови на липиди од хиломикрони и остатоци од VLDL. Истиот HDL исто така може да го фати холестеролот складиран во екстрахепатични ткива и да го пренесе на црниот дроб од обратна транспорт на холестерол (Сл. 21-40). Во една од обратните транспортни варијанти, интеракцијата на добиените HDL со SR-BI рецепторите во клетките богати со холестерол иницира пасивна дифузија на холестерол од клеточната површина во честички на HDL, кои потоа го пренесуваат холестеролот назад во црниот дроб. Во друга варијанта на обратна транспорт во богата холестерол ќелија, по расцепување на HDL, apoA-I комуницира со активниот транспортер, ABC протеинот. ApoA-I (и веројатно HDL) се апсорбира со ендоцитоза, потоа повторно се излачува, натоварен со холестерол, кој се транспортира до црниот дроб.
Протеинот ABC1 е дел од големото семејство на носители на многу лекови, овие носачи понекогаш се нарекуваат транспортери на ABC, бидејќи сите тие содржат ATP-касети за врзување (ATP - касети за врзување), тие исто така имаат две трансмембрански домени со шест трансмембрански хелики (види погл. 11, против 1). Овие протеини активно пренесуваат многу јони, аминокиселини, витамини, стероидни хормони и жолчни соли преку мембрани во плазмата. Друг претставник на ова семејство на превозници е протеинот CFTR, кој со цистична фиброза е оштетен (види додајте 11-3, с. 1).
Хостери на холестерол влегуваат во клетката преку ендоцитоза посредувана од рецептор
Секоја честичка LDL во крвотокот содржи apoB-100, која се препознава со специфични протеини на површински рецептори -LDL рецептори на мембраната на клетките што треба да го фати холестеролот. Врзаноста на LDL со LDL рецепторот иницира ендоцитоза, поради што LDL и неговиот рецептор се движат во клетката во внатрешноста на ендозомот (Сл. 21-42). Ендозомот на крајот се спојува со лизозомот, кој содржи ензими кои хидролизираат естери на холестерол, ослободувајќи холестерол и масни киселини во цитосолот. ApoB-100 од LDL исто така се распаѓа за да формира аминокиселини кои се излачуваат во цитосолот, но LDL рецепторот избегнува деградација и се враќа на клеточната површина за повторно да учествува во навлегувањето на LDL. ApoB-100 е исто така присутен во VLDL, но неговиот домен за врзување на рецептори не е во можност да се поврзе со LDL рецепторот; конверзијата на VLDLP во LDL го прави доменот за врзување на рецепторот во апоБ-100 достапен. Оваа патека за транспорт на холестерол во крвта и нејзината ендоцитоза посредувана од рецептор во целните ткива е проучена од Мајкл Браун и Josephозеф Голдстајн.
Мајкл Браун и Josephозеф Голдстајн

Сл. 21-42. Фаќање холестерол со ендоцитоза посредувана од рецептор.

Холестеролот, кој влегува во клетките на овој начин, може да се вклучи во мембрани или повторно да се естерифицира со ACAT (Сл. 21-38) за чување во цитосолот во липидните капки. Кога има доволно холестерол достапен во LDL фракцијата на крв, акумулацијата на вишок на меѓуклеточен холестерол се спречува со намалување на стапката на неговата синтеза.
LDL рецепторот, исто така, се врзува за аОЕ и игра значајна улога во апсорпцијата на хиломикрони и остатоци од VLDL од црниот дроб. Меѓутоа, ако LDL рецепторите не се достапни (како на пример, во вирус на глувчето со исчезнат ген за рецептор LDL), остатоците од VLDL и хиломикроните сè уште се апсорбираат во црниот дроб, иако LDL не се апсорбира. Ова укажува на присуство на помошен систем на резерва за ендоцитоза со посредство на рецептор на остатоци од VLDL и хиломикрон. Еден од резервните рецептори е LRP протеинот (протеин поврзан со липопротеински рецептори), кој е поврзан со липопротеински рецептори, кој се врзува за апоЕ и голем број други лиганди.
Неколку нивоа на регулирање на биосинтезата на холестерол
Синтезата на холестерол е комплексен и енергично скап процес, така што е јасно дека телото е корисно да има механизам за регулирање на биосинтезата на холестерол, кој ја надополнува неговата количина како додаток на она што доаѓа со храната. Кај цицачите, производството на холестерол се регулира со меѓуклеточна концентрација
холестерол и хормони глукагон и инсулин. Фазата на конверзија на HMG - CoA во мевалонат (Сл. 21-34) ја ограничува брзината во метаболичката патека на формирање на холестерол (главната точка на регулирање). Оваа реакција се катализира со HMG - CoA редуктаза. Регулацијата како одговор на промените во нивото на холестерол е посредувана со елегантен систем за регулирање на транскрипција за ген кој кодира редуктаза на HMG - CoA. Овој ген, заедно со повеќе од 20 други гени кои кодираат ензими кои се вклучени во апсорпцијата и синтезата на холестерол и незаситени масни киселини, е контролиран од мало семејство на протеини, наречени протеини, кои комуницираат со стероло-регулаторниот елемент на формирање на протеини (SREBP, стерол регулаторниот елемент што ги врзува протеините) . По синтезата, овие протеини се воведуваат во ендоплазматскиот ретикулум. Единствениот растворлив амино-терминален домен SREBP функционира како активатор за транскрипција користејќи ги механизмите опишани во Ch. 28 (v. 3). Сепак, овој домен нема пристап до јадрото и не може да учествува во активирање на генот додека останува во молекулот SREBP. Со цел да се активира транскрипција на генот HMG - CoA редуктаза и други гени, транскриптивно активниот домен е одвоен од остатокот на SREBP со протеолитичко расцепување. Кога холестеролот е висок, SREBP протеините се неактивни, фиксирани на ЕР во комплекс со друг протеин наречен SCAP (SREBP - протеини за активирање на расцеп) (Сл. 21-43). Тоа е SCAP што го врзува холестеролот и голем број други стероли, дејствувајќи како сензор за стерол. Кога нивото на стерол е високо, комплексот SCAP - SREBP веројатно комуницира со друг протеин, кој го задржува целиот комплекс во ER. Кога нивото на стероли во ќелијата се спушти, конформациската промена во SCAP доведува до губење на активност за задржување, а комплексот SCAP - SREBP мигрира во внатрешноста на везикулите до комплексот Golgi. Во комплексот Golgi, SREBP протеините се расцепуваат двапати на две различни протеази, втората расцепка ослободувајќи го амино-терминалниот домен во цитосолот. Овој домен се движи кон јадрото и ја активира транскрипцијата на целните гени. Амино-терминалниот протеин домен SREBP има краток полуживот и брзо се деградира со протеазомите (види слика 27-48, т. 3). Кога нивото на стерол се крева доволно, протеолитичкото ослободување на SR EBP протеините домени со амино терминалот повторно е блокирано, а деградацијата на протеазомот на постојните активни домени доведува до брзо исклучување на целните гени.
Сл. 21-43. Активирање на СР ЕБП. SREB P протеините кои комуницираат со елемент регулиран со стерол (зелена боја), веднаш по синтезата, се воведуваат во ЕР, формирајќи комплекс со S CAP (црвена боја). (N и C ги означуваат амините и карбоксилните краеви на протеините.) Во состојбата со S-CAP, протеините SRE BP се неактивни. Кога се намалува нивото на стерол, комплексот SR EBP-S CAP мигрира во комплексот Golgi, а протеините на SR EBP се секвенцијално расцепени со две различни протеази. Ослободениот домен на протеини со аминокиселини SR EBP мигрира во јадрото, каде го активира транскрипцијата на гени регулирани со стерол.

Синтезата на холестерол е регулирана и со неколку други механизми (Сл. 21-44). Хормоналната контрола е посредувана со ковалентна модификација на редуктазата на NM G-CoA. Овој ензим постои во фосфорилирани (неактивни) и дефосфорилизирани (активни) форми. Глукагонот ја стимулира фосфорилацијата (инактивацијата) на ензимот, а инсулин промовира дефосфорилација, активирање на ензимот и фаворизирање на синтезата на холестерол. Високите интрацелуларни концентрации на холестерол го активираат АСАТ, со што се зголемува естерификација на холестеролот за таложење. Конечно, високите нивоа на клеточен холестерол ја инхибираат транскрипцијата на генот кој кодира LDL рецептор, намалувајќи го производството на овој рецептор и, според тоа, навлегувањето на холестерол од крвта.
Сл. 21-44. Регулирањето на нивото на холестерол обезбедува баланс помеѓу синтезата и апсорпцијата на холестерол од храна. Глукагонот ја олеснува фосфорилацијата (инактивацијата) на редуктазата на NM G-CoA, инсулин промовира дефосфорилација (активирање). X - неидентификувани метаболити на холестерол кои ја стимулираат протеолизата на NM G-Co редуктазата.

Нерегулираниот холестерол може да доведе до сериозни заболувања кај луѓето. Кога вкупната количина на синтетизиран холестерол и холестерол добиен од храна ја надминува потребната количина за составување на мембрана, синтеза на жолчни соли и стероиди, може да се појават патолошки акумулации на холестерол во крвните садови (атеросклеротични плаки), што доведува до нивно блокирање (атеросклероза). Во индустријализираните земји, тоа е срцева слабост поради опструкција на коронарните артерии која е главната причина за смртност. Развојот на атеросклероза е поврзан со високо ниво на холестерол во крвта и особено со високо ниво на холестерол пренесен со фракцијата LDL, а високото ниво на HDL крв, напротив, поволно влијае на состојбата на крвните садови.
Со наследна хиперхолестеролемија (генетски дефект), нивото на холестерол во крвта е многу високо - тешка атеросклероза се развива кај овие луѓе веќе во детството. Поради неисправен рецептор на ЛДЛ, се јавува недоволно внесување на ЛДЛ холестерол посредувано од рецептор. Како резултат, холестеролот не се отстранува од крвотокот, тој се акумулира и придонесува за формирање на атеросклеротични плаки. Синтезата на ендоген холестерол продолжува и покрај вишокот холестерол во крвта, бидејќи екстрацелуларниот холестерол не може да влезе во клетката за регулирање на меѓуклеточната синтеза (Сл. 21 -44).За третман на пациенти со наследна хиперхолестеролемија и други заболувања поврзани со покачен серумски холестерол, се користат класи на статини. Некои од нив се добиени од природни извори, додека други се синтетизираат од фармацевтската индустрија. Статините се слични на мевалонатот (додадете 21-3) и се конкурентни инхибитори на редуктазата на NMS-CoA.
Додаток 21-3. МЕДИЦИНА. Липидна хипотеза и создавање на статини
Коронарна срцева болест (CHD) е главната причина за смртност во развиените земји. Стеснувањето на коронарните артерии кои носат крв на срцето се јавува како резултат на формирање на масни наслаги наречени атеросклеротични плаки; овие плакети содржат холестерол, фибриларни протеини, калциум, згрутчувања на тромбоцити и фрагменти од клетки. Во XX век. Се водеше активна дебата за односот помеѓу артериска опструкција (атеросклероза) и холестерол во крвта. Овие дискусии и активното истражување во оваа насока доведоа до создавање на ефективни лекови кои го намалуваат холестеролот.
Во 1913 година, Н.Н. Аничков, познат руски научник и специјалист во областа на експерименталната патологија, објави дело во кое покажа дека зајаците хранати со храна богата со холестерол развиваат оштетување на крвните садови кои личат на атеросклеротични плаки во садовите на стари лица. Аничков своето истражување го спроведуваше неколку децении и резултатите ги објави во добро познати западни списанија. За жал, неговите податоци не станаа основа за модел за развој на атеросклероза кај луѓето, бидејќи во тоа време преовладуваше хипотезата дека оваа болест е природен резултат на стареење и не може да се спречи. Сепак, доказите постепено се акумулираа врска помеѓу серумскиот холестерол и развојот на атеросклероза (липидна хипотеза) и во 1960-тите. некои истражувачи експлицитно изјавиле дека оваа болест може да се лекува со лекови. Како и да е, спротивната гледна точка постоеше сè до објавувањето во 1984 г. на резултатите од широката студија за улогата на холестерол спроведена од страна на Националниот национален институт за здравство на САД (Коронарна примарна постапка за превенција). Беше покажано статистичко значително намалување на зачестеноста на миокарден инфаркт и мозочни удари со намалување на холестеролот во крвта. Во оваа студија, холестеролот, анионска размена на смола што ги врзува жолчните киселини, се користеше за намалување на холестеролот. Резултатите ја стимулираа потрагата по нови, помоќни терапевтски лекови. Морам да кажам дека во научниот свет, сомнежите за валидноста на липидната хипотеза целосно исчезнаа само со доаѓањето на статини во доцните 1980-ти - раните 90-ти.
Првиот статин го открил Акира Ендо во Санкио во Токио. Ендо ја објави својата работа во 1976 година, иако се занимаваше со проблемот со метаболизмот на холестерол за неколку години. Во 1971 година, тој посочи дека инхибиторите на синтезата на холестерол, исто така, може да бидат содржани во производителите на печурки на антибиотици кои биле испитувани во тоа време. За неколку години интензивна работа, тој анализираше повеќе од 6.000 култури на разни печурки, сè додека не дојде до позитивен резултат. Како резултат на соединението беше наречено компактин. Оваа супстанца го намали холестеролот кај кучињата и мајмуните. Овие студии го привлекоа вниманието на Мајкл Браун и Josephозеф Голдстајн од Медицинскиот факултет на Универзитетот во Тексас Југозападен. Браун и Голдстајн, заедно со Ендо, започнале заедничка студија и ги потврдија неговите податоци. Главните успеси на првите клинички испитувања ги вклучиле фармацевтските компании во развојот на овие нови лекови. Во Мерк, тим предводен од Алфред Албертс и Рој Вагелос започна нов скрининг на култури на печурки и, како резултат на анализа на вкупно 18 култури, откри уште еден активен лек. Новата супстанција се нарекува ловастатин. Сепак, во исто време, се веруваше дека администрацијата на високи дози на компактин на кучиња доведува до развој на рак и потрага по нови статини во 1980-тите. е суспендиран. Сепак, до тоа време, придобивките од користењето на статини за лекување на пациенти со семејна хиперхолестеролемија биле веќе очигледни. По бројните консултации со меѓународни експерти и Управата за храна и лекови (ФДА, САД), Мерк започна да развива ловастатин. Опширните студии во текот на следните две децении не го откриваат канцерогениот ефект на ловастатин и новата генерација на лекови што се појавија по неа.
Сл. 1. Статините се инхибитори на редуктазата на NM G-CoA. Споредба на структурата на мевалонат и четири фармацевтски производи (статини) кои го инхибираат дејството на NM G -CoA редуктазата.

Статини го инхибираат дејството на HMG - CoA - редуктаза, имитирајќи ја структурата на мевалонат и со тоа ја блокираат синтезата на холестерол. Кај пациенти со хиперхолестеролемија предизвикана од дефект во една копија на ЛДЛ рецепторот, при земање на ловастатин, нивото на холестерол се намалува за 30%. Лекот е уште поефикасен во комбинација со специјални смоли кои ги врзуваат жолчните киселини и ја спречуваат нивната обратна апсорпција од цревата.
Во моментов, статините најчесто се користат за намалување на холестеролот во крвната плазма. Кога земате какви било лекови, се поставува прашањето за нивните непожелни несакани ефекти. Сепак, во случај на статини, многу несакани ефекти, за разлика, се позитивни. Овие лекови можат да го стимулираат протокот на крв, да ги поправат веќе постојните атеросклеротични плаки (така што тие не се отцепи од theидовите на крвните садови и не се мешаат во протокот на крв), да ја инхибираат агрегацијата на тромбоцитите и да ги ослабнат воспалителните процеси во theидовите на крвните садови. Кај пациенти кои земаат статини за прв пат, овие ефекти се манифестираат дури и пред да започнат да се намалуваат нивото на холестерол, и веројатно се поврзани со инхибиција на синтезата на изопреноид. Се разбира, не секој корисен ефект на статините е корисен. Кај некои пациенти (обично кај оние кои земаат статини во комбинација со други лекови кои го намалуваат холестеролот) може да се појават болки во мускулите и мускулна слабост, а понекогаш и во прилично силна форма. Регистрирани се и други доста бројни несакани ефекти на статините, кои, за среќа, ретко се појавуваат. Во огромното мнозинство на пациенти, земањето на статини може да го спречи развојот на кардиоваскуларни заболувања. Како и секој друг лек, статините треба да се користат само како што е препорачано од вашиот лекар.

Со наследно отсуство на HDL холестерол, нивото на холестерол е многу ниско, со болест Тангиер, холестеролот практично не е утврден. Двете генетски нарушувања се резултат на мутации на протеинот ABC1. Фракцијата на холестерол без HDL не може да го зафати холестеролот од клетките со недостаток на ABC1, а клетките исцрпени од холестерол брзо се отстрануваат од крвта и се уништуваат. И наследното отсуство на ХДЛ и Тангиерова болест е многу ретко (помалку од 100 семејства со Тангиерска болест се познати ширум светот), но овие заболувања ја демонстрираат улогата на АБЦ1 протеинот во регулирањето на нивото на плазма на ХДЛ. Бидејќи ниските нивоа на HDL во плазма се поврзани со висока стапка на оштетување на коронарна артерија, протеинот ABC1 може да биде корисна цел за лекови дизајнирани да ги регулираат нивоата на HDL. ■
Стероидните хормони се формираат со разделување на страничниот ланец на холестерол и негова оксидација.
Едно лице ги прима сите свои стероидни хормони од холестерол (Сл. 21-45). Две класи на стероидни хормони се синтетизираат во кората на надбубрежната жлезда: минералкортикоиди,кои ја регулираат апсорпцијата на неоргански јони (Na +, C l - и HC O) 3 -) во бубрезите и глукокортикоиди, кои помагаат во регулирање на глуконогенезата и го намалуваат воспалителниот одговор. Половите хормони се произведуваат во репродуктивните клетки на мажи и жени и во плацентата. Меѓу нив прогестерон кој го регулира женскиот репродуктивен циклус, андрогени (на пр. тестостерон) и естрогени (естрадиол), кои влијаат на развојот на секундарни сексуални карактеристики кај мажите и жените, соодветно. Стероидните хормони имаат ефект при многу ниски концентрации и затоа се синтетизираат во релативно мали количини. Во споредба со жолчките соли, релативно малку холестерол се троши за производство на стероидни хормони.

Сл. 21-45. Некои стероидни хормони се формираат од холестерол. Структурите на некои од овие соединенија се прикажани на сл. 10-19, с. 1.

Синтезата на стероидните хормони бара отстранување на неколку или на сите јаглеродни атоми во „страничниот ланец“ на Ц-17 Д-прстен на холестерол. Отстранувањето на страничниот ланец се јавува во митохондријата на стероидигените ткива. Процесот на отстранување се состои од хидроксилација на два соседни јаглеродни атоми на страничниот ланец (C-20 и C-22), потоа расцеп на врската помеѓу нив (Сл. 21-46). Формирањето на разни хормони вклучува и воведување на атоми на кислород. Сите реакции на хидроксилација и оксидација за време на стероидната биосинтеза се катализираат со мешани функции на оксидази (додај 21-1) кои користат NА D PH, O 2 и митохондријален цитохром П-450.
Сл. 21-46. Отстранување на страничниот ланец во синтезата на стероидните хормони. Во овој оксидаза систем со мешана функција што ги оксидира соседните атоми на јаглерод, цитохром П-450 делува како електронски носач. Исто така, вклучени во процесот се вклучени протеини што пренесуваат електрони, адреноксин и редуктаза на адреноксин. Овој систем на разделување на страничен ланец беше пронајден во митохондрија на надбубрежниот кортекс, каде се одвива активно производство на стероиди. Прегнанолонот е претходник на сите други стероидни хормони (Сл. 21-45).

Средници за биосинтеза на холестерол се вклучени во многу други метаболички патеки.
Покрај својата улога како посредник на биосинтезата на холестерол, изопентенил пирофосфат служи како активиран претходник во синтезата на огромен број биомолекули кои вршат различни биолошки функции (Сл. 21-47). Овие вклучуваат витамини А, Е и К, растителни пигменти, како што се каротин и хлорофил фитолен ланец, природна гума, многу есенцијални масла (на пример, миризлива основа на масло од лимон, еукалиптус, мошус), малолетнички хормон за инсекти што ја регулира метаморфозата, долихолите, што служат како растворливи во липидни носачи во сложената синтеза на полисахариди, ибикинон и пластоквинон - електронски носачи во митохондрија и хлоропласти. Сите овие молекули се структура изопреноиди. Пронајдени се повеќе од 20,000 различни изопреноиди во природата, а стотици нови се пријавуваат секоја година.
Сл. 21-47 година. Целокупната слика на биосинтезата на изопреноидите. Структурите на повеќето од крајните производи презентирани овде се дадени во поглавје. 10 (v. 1).

Преднилацијата (ковалентно прицврстување на изоопноид, видете на Сл. 27-35) е вообичаен механизам со кој протеините се зацврстуваат на внатрешната површина на мембраните на клетките на цицачите (види Сл. 11-14). Кај некои протеини, врзаниот липид е претставен со 15-јаглеродна фернезилна група, во други тоа е 20-јаглерод геранил групација. Овие два вида липиди приврзуваат различни ензими. Можно е реакциите на преднилацијата да ги насочуваат протеините кон различни мембрани во зависност од тоа на кој липид е прикачен. Плодувањето на протеините е уште една важна улога за изопродните деривати - учесници на метаболички пат на холестерол.
Резиме на Дел 21.4 Биосинтеза на холестерол, стероиди и изопреноиди
■ Холестеролот се формира од ацетил-CoA во комплексна реакција секвенца преку посредници како што се β-хидрокси-β-метилглутарил-CoA, мевалонат, две активирани изоопрена диметилалил пирофосфат и изопенентил пирофосфат. Кондензацијата на изопренските единици дава нецикличен сквален, кој циклусира за да формира кондензиран прстен систем и стероиден страничен ланец.
■ Синтезата на холестерол е под хормонална контрола и, покрај тоа, е инхибирана со зголемување на концентрациите на меѓуклеточен холестерол, што се јавува преку ковалентна модификација и регулирање на транскрипцијата.
Est Хостемите на холестерол и холестерол се пренесуваат преку крвта како липопротеини во плазмата. Фракцијата VLDL пренесува холестерол, холестерол естери и триацилглицероли од црниот дроб во други ткива, каде што триацилглицеролите се расцепат со липопротеини липаза и VLDL се претвора во ЛДЛ. Фракцијата LDL збогатена со естери на холестерол и холестерол е индиректно заробена од рецепторите со ендоцитоза, додека аполипропротеинот Б-100 во ЛДЛ се препознава преку рецепторите на плазма мембрана. ХДЛ го отстранува холестеролот од крвта, пренесувајќи го на црниот дроб. Нутрициони состојби или генетски дефекти во метаболизмот на холестерол може да доведат до атеросклероза и миокарден инфаркт.
■ Стероидните хормони (глукокортикоиди, минералокортикоиди и половни хормони) се формираат од холестерол со промена на страничниот ланец и воведување на атоми на кислород во стероидниот систем на прстените. Многу други изопреноидни соединенија се произведуваат од мевалонат со кондензација на изопентенил пирофосфат и диметилалил пирофосфат заедно со холестерол.
■ Преднилацијата на одредени протеини ги насочува кон местата за врзување со клеточните мембрани и е важна за нивната биолошка активност.
Прашање 48. Регулирање на метаболизмот на високи масни киселини (β-оксидација и биосинтеза). Синтеза на малонил CoA. Ацетил CoA карбоксилаза, регулирање на неговата активност. Транспортирање на ацил Ко-а преку внатрешната мембрана на митохондрија.
Главна
се троши количината на фенилаланин
на 2 начина:
се вклучува
во верверички,
се врти
во тирозин.
Вртење
првенствено фенилаланин до тирозин
потребно да се отстрани вишокот
фенилаланин, бидејќи се високи концентрации
Тоа е токсично за клетките. Образование
тирозин не е важно
од недостаток на оваа аминокиселина
во клетките практично не се случува.
Главна
започнува метаболизмот на фенилаланин
со својата хидроксилација (Сл. 9-29), во
што резултира во тирозин.
Оваа реакција е катализирана од специфична
монокси-наза - фенилаланин хидра (зисилаза,
кој служи како копродуцент
тетрахидробиоптерин (N4BP).
Активноста на ензимите исто така зависи
присуството на Fe2.
Во
црниот дроб првенствено е забрзана мобилизација
гликоген (види дел 7). Сепак, акции
гликогенот во црниот дроб е осиромашен
18-24 часа постење. Главен извор
гликоза како акции истекува
гликогенот станува глуконогенеза,
која започнува да се забрзува преку
Сл.
11-29. Големи метаболички промени
енергија при промена на абсорбента
поствосорбирана состојба. КТ
- тела на кетони, ФА - масни киселини.
4-6 ч
по последниот оброк. Подлоги
глицерол се користи за синтеза на глукоза,
аминокиселини и лактат. На високо
стапка на синтеза на концентрација на глукагон
масни киселини намалени поради
фосфорилација и инактивација
ацетил CoA карбоксилаза и стапка
п-оксидацијата се зголемува. Сепак,
зголемено снабдување со маснотии на црниот дроб
киселини кои се транспортираат
од масни складишта. Формирана е ацетил-CoA
во оксидација на масни киселини, се користи
во црниот дроб за синтеза на кетонски тела.
Во
масното ткиво со зголемена концентрација
глукагон намалена стапка на синтеза
ТАГ и липолизата се стимулираат. Стимулација
липолиза - резултат на активирање
хормон-чувствителна ТАГ-липаза
адипоцити под дејство на глукагон.
Масните киселини стануваат важни
извори на енергија во црниот дроб, мускули и
масно ткиво.
Така
на тој начин, во периодот на апсорпција
се одржува концентрација на гликоза во крвта
на ниво од 80-100 mg / dl и нивото на масни
киселини и кетонски тела се зголемува.
Шеќер
дијабетес е болест што се јавува
заради апсолутна или релативна
недостаток на инсулин.
А.
Главните клинички форми на шеќер
дијабетес
Според
Светска организација
здравствен дијабетес
класифицирани според разликите
генетски фактори и клинички
две главни форми: дијабетес
Тип I - зависен од инсулин (IDDM) и дијабетес
Тип II - независен инсулин (NIDDM).
Регулатива
синтеза на zhk.Регуларен ензим
синтеза на ЛЦД - ацетил CoA карбоксилаза.
Овој ензим е регулиран со неколку
начини.
Активирање / дисоцијација
комплексни ензимски субвенции. Во
неактивна форма на ацетил CoA карбоксилаза
претставува одделни комплекси,
од кои секоја се состои од 4 под-единици.
Активаторот на ензимот е цитрат. Стимулира
комбинација на комплекси, како резултат
при што се зголемува ензимската активност
. Инхибитор-палмитоил-CoA. Тој се јавува
сложена дисоцијација и намалување
активност на ензимите.
Фосфорилација / дефосфорилација
ацетил CoA карбоксилаза. Во
состојба на постсорпција или во
физичка работа глукагонизирана
адреналин преку аденилат циклаза
системот се активира со прокиназа А и
стимулирање на фосфорилацијата на субјектот
ацетил CoA карбоксилаза. Фосфорилиран
ензимот е неактивен и синтеза на масни
киселини запира.
Абсорбента
период инсулин активира фосфатаза,
а ацетил-CoA карбоксилазата влегува во
дефосфорилизирана состојба. Тогаш
се јавува под влијание на цитрат
полимеризација на протомите на ензимот и
тој станува активен. Во прилог на активирање
ензим, цитрат врши друг
функција во синтезата на ЛЦД. Абсорбента
период во митохондријата на клетките на црниот дроб
акумулира цитрат, во која
остатокот на ацил се транспортира до
цитозол.
Регулатива
стапки на б-оксидација.
В-оксидација-метаболички пат,
цврсто поврзани со работата на ЦПЕ и општо
начини на катаболизам. Затоа нејзината брзина
регулирано со потребата од клетки за
енергија т.е. според односот на АТП / АДП и НАДХ / НАД, како и стапката на реакција на ЦПЕ и
заедничка патека на катаболизам. Брзина
β-оксидацијата во ткивата зависи од достапноста
подлогата, т.е.
на количината на масни
киселини кои влегуваат во митохондриите.
Бесплатна концентрација на масни киселини
во крвта се крева при активирање
липолиза во масното ткиво за време на постот
под влијание на глукагон и за време на физичко
работа под влијание на адреналин. Во овие
масните киселини стануваат
доминантен извор на енергија
за мускули и црниот дроб, како резултат на
β-оксидациите се формираат со инхибиција на NADH и ацетил-CoA
комплексот пироват дехидрогеназа.
Трансформација на формирање на пируват
од гликоза до ацетил-CoA забавува.
Средни метаболити се акумулираат
гликолиза и, особено, гликоза-6-фосфат.
Гликозата-6-фосфат инхибира хексокиназа
и затоа обесхрабрува
употреба на гликоза во процесот
гликолиза. Затоа, доминантна
употреба на ЛЦД како главен извор
енергија во мускулното ткиво и црниот дроб
заштедува гликоза за нервно ткиво и
црвени крвни клетки.
Б-оксидација стапка исто така
зависи од активноста на ензимите
карнитинска ацилтрансферас I.
Во црниот дроб, овој ензим е инхибиран.
маланил CoA, формирана супстанција
со биосинтеза на ЛЦД. Во периодот на апсорпција
гликолизата се активира во црниот дроб и
се зголемува формирање на ацетил-CoA
од пироват. Прва реакција на синтеза
LCD конверзија на ацетил-CoA во малонил-CoA.
Малонил-CoA ја инхибира β-оксидацијата на ЛЦД,
што може да се користи за синтеза
маснотии.
Образование
малонил-CoA од ацетил-CoA-регулатор
реакција во биосинтеза ЛЦД. Прва реакција
синтеза lcd конверзија на ацетил-CoA во
малонил CoA. Каталитички ензим
оваа реакција (ацетил Коа карбоксилаза),
припаѓаат на класата на лигази. Тој содржи
ковалентно врзан биотин. Во првиот
co2 ковалентна фаза на реакција
се врзува за биотинот заради енергијата
АТП, во фаза 2 COO- пренесе
на ацетил-CoA за формирање на малонил-CoA.
Активност на ензимот на ацетил CoA карбоксилаза
ја одредува брзината на сите последователни
реакции на синтеза lc
цитрат активира ензим во цитосол
ацетил CoA карбоксилаза. Малонил CoA во
за возврат го спречува трансферот на повисоки
масни киселини од цитосол до матрица
инхибиторна активност на митохондрија
надворешен ацетил CoA: карнитин ацилтрансфераза,
со што се исклучува оксидацијата на повисоки
масни киселини.
Ацетил-CoA оксалоацетат
Цитрат HS-CoA

HSCOA ATP Citrate → Acetyl-CoA ADP Pi Oxaloacetate
Ацетил-CoA
во цитоплазмата служи како почетна подлога
во за синтеза на ЛЦД и оксалоацетат во
цитозол се подложува на трансформации во
резултат на кој се формира пироват.
Биосинтеза на холестерол
Биосинтезата на холестерол се јавува во ендоплазматскиот ретикулум. Изворот на сите атоми на јаглерод во молекулот е ацетил-SCoA, кој доаѓа од митохондриите како дел од цитрат, како во синтезата на масни киселини. Биосинтезата на холестерол троши 18 АТП молекули и 13 молекули на NADPH.
Формирањето на холестерол се јавува во повеќе од 30 реакции, кои можат да се групираат во неколку фази.
1. Синтеза на мевалонска киселина.
Првите две реакции на синтеза се совпаѓаат со реакциите на кетогенеза, но по синтезата на 3-хидрокси-3-метилгутарил-ScoA, влегува ензимот хидроксиметил-глутарил-ScoA редуктаза (HMG-SCOA редуктаза), формирајќи мевалонска киселина.
 |