Виктоза - официјални упатства за употреба
Форма на дозирање - раствор за поткожно администрирање: безбоен или скоро безбоен (3 мл секоја * во стаклени касети, кои се запечатени во пластично пенкало за еднократна употреба за повторни инјекции, во картонски пакет од 1, 2 или 3 пенкала за шприц).
* Во 1 пенкало за шприц (3 ml) содржи 10 дози од 1,8 мг, 15 дози од 1,2 мг или 30 дози од 0,6 мг.
Активна супстанција: лираглутид, во 1 ml - 6 мг.
Помошни компоненти: хлороводородна киселина / натриум хидроксид, т.е., натриум хидроген фосфат дихидрат, фенол, пропилен гликол, вода за инјектирање.
Фармаколошки својства:
Фармакодинамика
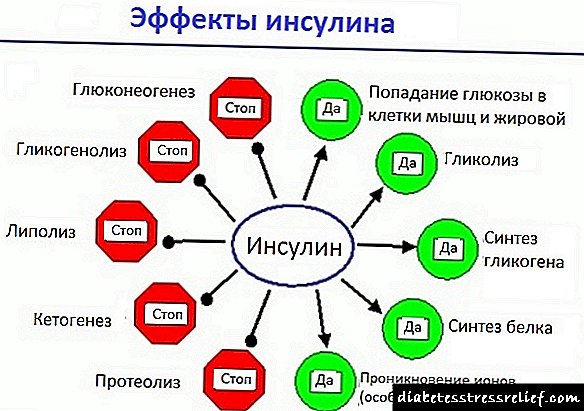
Лираглутид има долг 24-часовен ефект и ја подобрува гликемиската контрола со намалување на концентрацијата на глукоза во постот што постепено и после јадење кај пациенти со дијабетес тип 2.
Секретирано инсулин зависно од гликоза
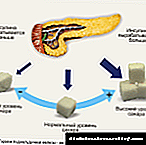
Со зголемување на концентрацијата на глукоза во крвта, лираглутид го зголемува лачењето на инсулин. При употреба на чекор-инфузија на глукоза, секрецијата на инсулин после администрација на единечна доза лираглутид кај пациенти со дијабетес мелитус тип 2 се зголемува до ниво споредливо со онаа на здрави субјекти (Сл. 1).

Функција на бета клетките на панкреасот
Лираглутид ја подобри функцијата на бета клетките на панкреасот, што е потврдено од првата и втората фаза на реакција на инсулин и максималната секреторен активност на бета клетките. Фармакодинамичките студии на пациенти со дијабетес тип 2 покажаа реставрација на првата фаза на секреција на инсулин (интравенска администрација на инсулин), подобрување на втората фаза на секреција на инсулин (тест за хипергликемиски стегач) и максимална секреторен активност на инсулин (тест за стимулација на аргинин).
За време на 52-неделната терапија со Виктоза ®, се забележува подобрување на функцијата на бета клетките на панкреасот, што е потврдено со проценката на хомеостатскиот модел на функцијата на бета клетките на панкреасот (индекс HOMA) и односот на инсулин кон проинсулин.
Секреција на глукагон:
Лираглутид, стимулирајќи го секретот на инсулин и го инхибира секрецијата на глукагон, ја намалува концентрацијата на глукоза во крвта. Лираглутид не го инхибира реакцијата на глукагон на ниски концентрации на гликоза. Покрај тоа, наспроти позадината на лираглутид, забележано е пониско производство на ендогена гликоза.
Гастрично празнење:
Лираглутид предизвикува мало одложување на празнењето на желудникот, со што се намалува интензитетот на постпрандијална гликоза во крвта.
Телесната тежина, составот на телото и потрошувачката на енергија:
Кај субјекти со зголемена телесна тежина вклучени во долгорочни клинички студии на лираглутид, последното предизвика значително намалување на телесната тежина. Скенирањето со употреба на компјутеризирана томографија (КТ) и методите на двојна рендгенска апсорптометрија (ДЕРА) покажа дека губењето на телесната тежина се случи првенствено како резултат на губење на масното ткиво на пациентите. Овие резултати се објаснуваат со фактот дека за време на терапијата со лираглутид кај пациенти, гладот и потрошувачката на енергија се намалуваат.
Електрофизиологија на срцето (Efc):
Ефектот на лираглутид врз процесот на реполаризација во срцето беше тестиран во студија за ЕФС. Употребата на лираглутид во концентрација на рамнотежа во дневна доза до 1,8 mg не дава продолжување на EPS.
Клиничка ефикасност
3992 пациенти со дијабетес мелитус тип 2 беа рандомизирани во 5 клинични испитувања за безбедност и ефикасност со двојно слепи лица, спроведени за да се процени ефектот на Виктоза ® врз гликемиската контрола. Терапијата со Виктоза produced има клинички и статистички значајни подобрувања во HbA1-тиконцентрации на глукоза и постпадијална гликоза, во споредба со плацебо.
Гликемиска контрола
Лекот Виктоза 52 во форма на монотерапија 52 недели предизвика статистички значаен (p ®, додека кај пациенти кои учествуваат во клинички испитувања за комбинирана употреба на лекот Виктоза ®, просечна HbA1-ти намален за 1,1-2,5%.
Лекот Виктоза ® за време на 26-неделната комбинирана терапија со метформин, сулфонилуреа препарати или метформин и тиазолидидион предизвика статистички значајна (® met и метформин, додавањето на инсулин детмир обезбеди поголема ефикасност во однос на лекот Виктоза ® и метаформин после 26 недели од третманот (намалување HbA1c за 0,52%).
Докажано е дека ефективноста на лекот Виктоза ® во доза од 0,6 мг во комбинација со сулфонилуреа или препарати на метформин е супериорна во однос на плацебо, но во исто време пониска отколку во дози од 1,2 мг и 1,8 мг.
Односот на пациенти кои постигнале намалување на HbA1-ти
Наспроти позадината на монотерапија со Виктоза ® за време на 52-недела студија, бројот на пациенти кои оствариле HbA1-ти Combination во комбинација со метформин, сулфонилуреа, деривати или комбинација на метформин и тиазолидидион, број на пациенти кои достигнале HbA1-ти ≤ 6,5%, статистички значајно (p ≤ 0.0001) се зголеми во однос на бројот на пациенти кои примале терапија сам, без додавање на Виктоза with, со хипогликемични лекови.
Кај групи пациенти кои не постигнале соодветна гликемиска контрола за време на терапијата со Виктоза ® и метформин, процентот на пациенти кои ја постигнале целта HbA1-ти (® постигна HbA1-ти ® и во форма на монотерапија и во комбинација со еден или два орални хипогликемични агенси. Ова намалување беше забележано веќе во првите две недели од почетокот на третманот.
Постпрандијална гликемија
Употребата на лекот Виктоза ® за три дена земање на вообичаена храна помогна да се намали концентрацијата на постпрандијална гликоза за 31-49 mg% (1,68-2,71 mmol / l).
Телесна тежина
52-недела монотерапија со Виктоза oza беше поврзана со одржливо слабеење.
Во текот на целиот период на клиничка студија, одржливото слабеење е исто така поврзано со употреба на Виктоза ® во комбинација со метформин и во комбинација со метформин и сулфонилуреа или комбинација на метформин и тиазолидидион.
Губење на тежината кај пациенти кои примаат Виктоза ® во комбинација со метформин, исто така, е забележано по додавањето на инсулин демимир.
Најголем пад на телесната тежина е забележан кај пациенти кои имале зголемен индекс на телесна маса (BMI) на почетната точка на студијата.
Монотерапија со Виктоста ® за 52 недели предизвика намалување на просечниот обем на половината за 3,0-3,6 см.
Намалување на телесната тежина е забележано кај сите пациенти кои примале терапија со Виктоза ®, без оглед на тоа дали доживеале несакана реакција во форма на гадење.
Лекот Виктоза ® како дел од комбинираната терапија со метформин го намали обемот на поткожното масно ткиво за 13-17%.
Безалкохолна стеатохепатоза
Лираглутид ја намалува сериозноста на стеатохепатозата кај пациенти со дијабетес тип 2.
Крвен притисок
Долгорочните клинички студии покажаа дека лекот Виктоза ® го намалува систолниот крвен притисок во просек од 2,3-6,7 mm Hg. во првите две недели од третманот. Намалување на систолниот крвен притисок се случи пред почетокот на губење на тежината.
Други клинички податоци
Во компаративна студија за ефикасноста и безбедноста на лекот Виктоза ® (во дози од 1,2 мг и 1,8 мг) и инхибиторот на дипептидил пептидаза-4 ситаглиптин во доза од 100 мг кај пациенти кои не оствариле соодветна контрола врз терапијата со метформин, најдобриот пад се докажал после 26 недели од третманот HbA1-ти при употреба на лекот Виктоза ® во двете дози во споредба со ситаглиптин (-1,24%, -1,50% во однос на -0,90%, п ® во споредба со ситаглиптин (43,7% и 56,0% од споредено со 22,0%, p ® е значително повисоко во споредба со пациентите кои примале ситаглиптин (-2,9 кг и -3,4 кг, споредено со -1,0 кг, п, гадење беше почеста. гадење беше минливо, а инциденцата на лесна хипогликемија не беше значително различна кога се третира со Виктоза ® и ситаглиптин (0,178 и 0,161, споредено со 0,106 случаи / пациент годишно).1-ти а предноста на Виктоза ® во однос на ситаглиптин е забележана по 26-та недела од третманот со Виктоза ® (1,2 мг и 1,8 мг) и беше потврдена по 52-та недела од третманот (-1,29% и -1,51% споредено со -0,88%, p ®, што доведе до дополнително и статистички значајно намалување на HbA1-ти на 78-та недела од третманот (0,24% и 0,45%, 95 Cl: од 0,41 до 0,07 и од -0,67 до 0,23).
Во компаративна студија за ефикасноста и безбедноста на лекот Виктоза ® (во доза од 1,8 мг) и егзенатид (во доза од 10 μg два пати на ден) кај пациенти кои не оствариле соодветна контрола на терапијата со деривати на метформин и / или сулфонилуреа, по 26 недели од употребата на лекот Виктоза ® забележа поголемо намалување на HbA1-ти споредено со егзенатид (-1,12% споредено со -0,79%, p ® во споредба со егзенатид (54,2% споредено со 43,4%, п = 0,0015). И двете терапии покажаа просечна загуба телесна тежина од приближно 3 кг. Бројот на пациенти кои пријавиле гадење е помал кај групата пациенти кои примале лек Виктоза ®, споредено со егзенатид. Инциденцата на лесна хипогликемија е значително пониска кај групата пациенти кои примале лек Виктоза ®, споредено со егзенатид ( 1 932 споредено со 2 600 случаи / пациенти годишно, п = 0,01). После 26 недели администрација на егзенатид, пациентите би беа пренесени во Виктоза ®, што доведе до дополнително намалување на HbA1-ти на 40-та недела од третманот (-0,32%, p ® за 52 недели ја подобри чувствителноста на инсулин во споредба со онаа на препаратите на сулфонилуреа, која беше откриена со користење на хомеостатскиот модел за проценка на HOMA-IR отпорноста на инсулин).
Фармакокинетика
Апсорпција
Апсорпцијата на лираглутид по субкутана администрација е бавна, времето за постигнување на максималната концентрација на плазма е 8-12 часа по дозата на лекот. Максимална концентрација (Cмакс) лираглутид во плазма по субкутана инјекција во единечна доза од 0,6 мг е 9,4 nmol / L. Со воведување на лираглутид во доза од 1,8 mg, просечен показател за неговата концентрација на плазма на рамнотежа во плазмата (AUC?/24) достигнува приближно 34 nmol / L. Изложеноста на лираглутид е подобрена во однос на администрираната доза. По администрација на лираглутид во единечна доза, коефициентот на интрапопулација на варијацијата во пределот под кривата на време на концентрација на AUC е 11%. Апсолутната биорасположивост на лираглутид по субкутана администрација е приближно 55%.
Дистрибуција
Очигледниот волумен на дистрибуција на лираглутид во ткивата по субкутана администрација е 11-17 литри. Просечниот волумен на дистрибуција на лираглутид по интравенска администрација е 0,07 л / кг. Лираглутидот во голема мерка се врзува за плазма протеините (> 98%).
Метаболизам
За 24 часа по администрацијата на здрави доброволци од единечна доза од 3-лираглутид обележана со радиоактивен изотоп, главната плазма компонента остана непроменета лираглутид. Откриени се два плазма метаболити (≤ 9% и ≤ 5% од вкупната плазма радиоактивност). Лираглутид се метаболизира ендогени, како големи протеини, без притоа да се вклучи некој специфичен орган како екскреторен пат.
Одгледување
По администрација на доза од 3 Н-лираглутид, непроменет лираглутид не е откриен во урина или измет. Само мал дел од администрираната радиоактивност во форма на метаболити поврзани со лираглутид (6% и 5%, соодветно) се излачува од бубрезите или преку цревата. Радиоактивните супстанции се излачуваат од бубрезите или преку цревата, главно во текот на првите 6-8 дена по дозата на лекот и се три метаболити. Просечниот клиренс од телото после субкутана администрација на лираглутид во единечна доза е приближно 1,2 l / h со полуживот на елиминација од приближно 13 часа.
Специјални групи на пациенти
Старост: Податоците од фармакокинетичките студии во група на здрави доброволци и анализа на фармакокинетичките податоци добиени кај популацијата на пациенти (од 18 до 80 години) укажуваат дека возраста нема клинички значаен ефект врз фармакокинетичките својства на лираглутид.
Пол: Фармакокинетичка анализа заснована врз популацијата на податоците добиени со проучување на ефектот на лираглутид кај жени и машки пациенти, а фармакокинетичките студии во група на здрави доброволци укажуваат на тоа дека полот нема клинички значаен ефект врз фармакокинетичките својства на лираглутид.
Етничка припадност: Фармакокинетичка анализа базирана на популацијата на податоците добиени со проучување на ефектите на лираглутид кај субјекти од бела, црна, азиска и шпанска расна група сугерира дека етничката припадност нема клинички значаен ефект врз фармакокинетичките својства на лираглутид.
Дебелината: Фармакокинетичка анализа базирана на население, покажува дека индексот на телесна маса (BMI) нема клинички значаен ефект врз фармакокинетичките својства на лираглутид.
Неуспех на црниот дроб:
Фармакокинетичките својства на лираглутид се изучувале во клиничка студија за единечна доза на лекот кај лица со различен степен на слабост на црниот дроб. Пациентите со лесна хепатална инсуфициенција (според класификацијата Child Pugh, сериозноста на болеста од 5 - 6 поени) и тешка хепатална инсуфициенција (според класификацијата Child Pugh, сериозноста на болеста> 9 поени) беа вклучени во студијата. Изложеноста на лираглутид кај групата пациенти со нарушена функција на црниот дроб не била повисока од онаа кај групата здрави субјекти, што укажува дека слабоста на црниот дроб нема клинички значаен ефект врз фармакокинетиката на лираглутид.
Бубрежна инсуфициенција:
Фармакокинетиката на лираглутид е изучена кај пациенти со различен степен на бубрежна инсуфициенција во единечна доза. Оваа студија опфати субјекти со различен степен на ренална инсуфициенција: од блага (проценка на дозвола за креатинин од 50-80 ml / мин) до тешка (проценка на дозвола за креатинин кај деца не е извршена.
Пкклинички податоци за студија за безбедност
Резултатите од претклинички клинички токсиколошки студии со воведување на повторени дози на лекот, вклучително и генотоксичност, покажаа дека употребата на лираглутид не претставува закана за здравјето на луѓето.
Тимороидни Ц-клетки на стаорци и глувци биле идентификувани во текот на двегодишни студии за канцерогеноста на лекот кај глодари и не довеле до смрт. Не е токсична доза (НОАЕЛ) не е утврдена кај стаорци. Појавување на вакви тумори кај мајмуните третирани со лираглутид 20 месеци не беше забележано. Резултатите добиени во студиите за глодари се поврзани со фактот дека глодарите се особено чувствителни на не-генотоксичен специфичен механизам посредуван од рецепторот GLP-1. Значењето на добиените податоци за луѓето е мало, но не може целосно да се исклучи. Појавата на какви било други неоплазми поврзани со терапијата не беше забележана.
Студиите за животни не откриле директен несакан ефект на лекот врз плодноста, но има мало зголемување на зачестеноста на раната ембрионска смрт за време на третманот со најголема доза на лекот. Воведувањето на лекот Виктоза ® кај стаорци во средината на бременоста ги натерало да ја намалат телесната тежина на мајката и растот на ембрионот со некомплетно проучен ефект врз ребрата и отстапувања во скелетната структура во групата зајаци. Растот на новороденчиња во групата на стаорци се намали за време на терапијата со Виктоза, а ова намалување упорно опстојува по доењето во групата модели кои примаат високи дози на лираглутид. Не е познато што предизвикало такво намалување на растот на новороденчиња - намалување на потрошувачката на млеко на нивната мајка како резултат на директно влијание на GLP-1, или недоволно производство на мајчино млеко од стаорци кај мајчињата како резултат на намалување на внесот на калории.
Дозирна форма
Поткожен раствор 6 мг / мл
1 ml раствор содржи
активна супстанција - лираглутид 6 мг,
ексципиенси: натриум хидроген фосфат дихидрат, пропилен гликол, фенол, хлороводородна киселина (раствор 2М) / натриум хидроксид (раствор 2М), вода за инјектирање.
Транспарентно безбоен или скоро безбоен раствор, практично без механички нечистотии.
Дозирање и администрација
Лекот Виктоза® се користи еднаш дневно во секое време, без оглед на внесувањето храна, може да се администрира како поткожна инјекција во абдоменот, бутот или рамото. Местото и времето на инјектирање може да варира без прилагодување на дозата. Сепак, подобро е да се зема лекот во приближно исто време од денот, во времето што е најзгодно за пациентот. Дополнителни информации за начинот на употреба на лекот Виктоза® може да се најдат во делот за употреба и отстранување. Лекот Viktoza® не може да се користи за интравенска и интрамускулна администрација.
Првичната доза на Виктоза® е 0,6 мг на ден. По употребата на лекот најмалку една недела, дозата треба да се зголеми на 1,2 мг. Постојат докази дека кај некои пациенти користа од третманот се зголемува со зголемување на дозата на лекот од 1,2 mg на 1,8 mg. За да се постигне најдобра гликемиска контрола кај пациент и да се земе предвид клиничката ефикасност, дозата на Виктоза® може да се зголеми на 1,8 мг по употреба во доза од 1,2 мг најмалку една недела. Не се препорачува употреба на лекот во дневна доза над 1,8 mg.
Лекот Виктоза® може да се користи како додаток на постојната терапија со метформин или комбинирана терапија со метформин и тиазолидидион. Терапијата со метформин во комбинација со тиазолидидион може да се продолжи во тековни дози.
Victoza® може да се користи како додаток за време на постојната терапија со сулфонилуреа или комбинирана терапија со метформин и сулфонилуреа или базален инсулин. Кога Viktoza® ќе се додаде на сулфонилуреа или базална инсулинска терапија, треба да се земе предвид дозата за намалување на сулфонилуреа или базален инсулин со цел да се минимизира ризикот од несакана хипогликемија (види дел "Посебни упатства").
За прилагодување на дозата на лекот Виктоза®, не е потребно самостојно следење на гликозата во крвта. Како и да е, на почетокот на терапијата со Viktoza® во комбинација со деривати на сулфонилуреа или со базален инсулин, може да биде потребно такво самостојно следење на гликозата во крвта за да се прилагоди дозата на препарати на сулфонилуреа.
Специјални групи на пациенти
Постари лица (> 65 години): Не е потребен избор на доза во зависност од возраста. Постои ограничено искуство со употреба на лекот кај пациенти на возраст од 75 години и постари (види дел „Фармакокинетика“).
Пациенти со нарушена бубрежна функција
Нема потреба од прилагодување на дозата при третман на пациенти со лесна форма на бубрежна инсуфициенција (клиренс на креатинин 60 - 90 ml / мин). Постои само многу ограничено искуство во лекување на пациенти со умерена бубрежна инсуфициенција (клиренс на креатинин 30-59 ml / мин) и нема податоци за третман на пациенти со тешка бубрежна инсуфициенција (клиренс на креатинин под 30 ml / мин). Во моментов, Виктоза не се препорачува за употреба кај пациенти со тешки или умерени форми на бубрежна инсуфициенција, вклучително и пациенти во терминална фаза на бубрежна болест (видете во делот Фармакокинетика)
Пациенти со нарушена функција на црниот дроб
Искуството за лекување на пациенти со сите форми на слабост на црниот дроб (блага, умерена и тешка) во моментов е премногу ограничено за да се препорача употреба на Виктоза (види дел Фармакокинетика).
Педијатриска популација на пациенти
Лекот Виктоза не се препорачува за деца и адолесценти на возраст под 18 години, поради недостаток на податоци за безбедноста и ефективноста на неговата употреба.
Несакани ефекти
Во клиничките испитувања, најчесто пријавени несакани ефекти од гастроинтестиналниот тракт: гадење и дијареја (забележано кај> 10% од пациентите), повраќање, запек, болки во стомакот и диспептични симптоми (евидентирани во ≥ 1%, но 10 ≤ % од пациентите).
На почетокот на терапијата со Viktoza®, овие гастроинтестинални несакани ефекти може да се појават почесто, но како што продолжува третманот, реакциите обично се намалуваат во текот на неколку дена или недели. Несакани реакции во форма на главоболка и инфекции на горниот респираторен тракт беа забележани релативно често (1 - 10% од пациентите). Покрај тоа, можен е развој на хипогликемични состојби, особено при употреба на лекот Виктоза® во комбинација со деривати на сулфонилуреа (регистрирани кај> 10% од пациентите). Тешка хипогликемија главно се развива против позадината на комбинираната употреба на лекот Виктоза® со сулфонилуреа.
Сериозни несакани ефекти се пријавени многу ретко.
Опис на индивидуалните несакани реакции
Во клиничка студија користејќи лираглутид како монотерапија, инциденцата на хипогликемија со лираглутид е помала од инциденцата на хипогликемија кај пациенти третирани со референтен лек (глимепирид). Најчестите несакани реакции вклучуваат гастроинтестинални заболувања, инфекции и наезда.
Повеќето епизоди на потврдена хипогликемија кај клиничките испитувања беа занемарливи. Во една студија користена лираглутид како монотерапија, немало сериозни случаи на хипогликемија. Сериозните епизоди на хипогликемија не се вообичаени и првично беа забележани со употреба на лираглутид во комбинација со сулфонилуреа (0,02 епизоди по години на пациент). Беше забележан многу мал број на епизоди (0,001 епизоди на пациенти години) со употреба на лираглутид во комбинација со орални антидијабетични агенси, освен сулфонилуреа. Ризикот од хипогликемија е мал со комбинирана употреба на базален инсулин и лираглутид (1,0 епизода по години на пациент, видете во делот Фармакодинамика).
Гастроинтестинални несакани реакции
Кога биле комбинирани лираглутид и метформин, 20,7% од пациентите пријавиле најмалку една епизода на гадење и 12,6% од пациентите пријавиле најмалку една епизода на дијареја.
Кога лираглутид во комбинација со сулфонилуреа, 9,1% од пациентите пријавиле најмалку една епизода на гадење и 7,9% од пациентите пријавиле најмалку една епизода на дијареја. Повеќето несакани ефекти биле благи или умерени по природа и имаат зависност од доза.
Со продолжено лекување, фреквенцијата и сериозноста се намалиле кај повеќето пациенти кои имале гадење во почетната фаза.
Кај пациенти постари од 70 години, при третман со лираглутид, почесто може да се појават гастроинтестинални нарушувања.
Кај пациенти со блага до умерена бубрежна инсуфициенција (клиренс на креатинин од 60-90 ml / мин и 30-59 ml / мин, соодветно), може да се појават повеќе гастроинтестинални несакани реакции за време на третманот со лираглутид.
Исклучување на пациенти од испитувања
Кај долгорочни контролирани испитувања (26 недели или повеќе), процентот на пациенти исклучени од тестот како резултат на несакани реакции изнесува 7,8% кај пациенти кои биле подложени на третман со лираглутид и 3,4% за пациенти од групата за третман на споредба. Најчестите несакани реакции што доведоа до повлекување на судењето при третман на пациенти со лираглутид вклучуваат гадење (2,8% од пациентите) и повраќање (1,5% од пациентите).
Реакции на местото на инјектирање
Реакција на местото на инјектирање на лекот е забележано кај приближно 2% од пациентите во текот на долгорочни контролирани клинички испитувања на Виктоза (26 недели или повеќе). Овие реакции обично беа мали.
Во текот на долгите контролирани клинички испитувања на Виктоза (26 недели или повеќе), има извештаи за неколку случаи на акутен панкреатит (
Контраиндикации
- Преосетливост на активната супстанција или друга
компонентите што го сочинуваат лекот
- употреба кај пациенти со дијабетес тип 1
- за третман на дијабетична кетоацидоза
тешка бубрежна и хепатална инсуфициенција
- детска и тинејџерска возраст до 18 години
- бременост и лактација
Интеракции со лекови
Ин витро проценка на интеракција со лекови
Лираглутид покажа мала способност за фармакокинетска интеракција со лекови поради метаболизмот во цитохром П-450 (ЦИП) системот, како и врзување за плазма протеините.
Ин виво проценка на интеракција со лекови
Мало одложување на празнење на желудник при употреба на лираглутид може да влијае на апсорпцијата на истовремени лекови наменети за орална администрација. Студиите за интеракција со лекови не покажаа клинички значајно забавување на апсорпцијата на овие лекови. Неколку пациенти третирани со Виктоза® имаа најмалку една епизода на акутна дијареја. Дијареата може да влијае на апсорпцијата на оралните лекови што се користат истовремено со Виктоза.
Варфарин и други деривати на кумарин
Студии за интеракција на двата лека не се спроведени. На почетокот на третманот со Виктоза, кај пациенти кои примаат варфарин или други деривати на кумарин, се препорачува почесто да се следи INR (Меѓународен нормализиран однос).
Лираглутид не предизвика промена во општото дејство на парацетамол по неговата администрација во единечна доза од 1000 мг. Максималната концентрација на парацетамол во плазмата (Cmax) се намали за 31%, а просечното време да се достигне врв во неговата концентрација (tmax) во крвната плазма беше продолжено за 15 минути. Со истовремена администрација на лираглутид и парацетамол не е потребно прилагодување на дозата на вториот.
Лираглутид не предизвика клинички значителна промена во општиот ефект на аторвастатин по неговата администрација во единечна доза од 40 мг. Така, прилагодување на дозата на аторвастатин при земање на Виктоза® не е потребно. Максималната концентрација на аторвастатин во плазмата (Цмакс) се намали за 38%, а просечното време да се достигне врв во концентрацијата на плазма (тмакс) кај пациенти кои примаат лираглутид издолжено од еден до три часа.
Лираглутид не предизвика промена во општиот ефект на гризофулвин по администрација на истиот во единечна доза од 500 мг. Максималната концентрација на гризоофулвин (Cmax) се зголеми за 37%, додека просечното време да се достигне својата максимална концентрација (tmax) во плазмата не се промени. Не е потребно прилагодување на дозата на гризеофулвин и други лекови со мала растворливост и висока пропустливост.
Воведувањето на дигоксин во единечна доза од 1 мг со употреба на лираглутид покажа намалување на подрачјето под кривата (AUC) на дигоксин за 16%, максималната концентрација на плазма (Cmax) на дигоксин се намали за 31%. Просечното време за постигнување на врвната концентрација (тмакс) на дигоксин при земање лираглутид се зголеми од еден на еден и пол часа. Врз основа на добиените резултати, прилагодување на дозата на дигоксин при земање на лираглутид не е потребно.
Администрација на лизиноприл во единечна доза од 20 мг при употреба на лираглутид покажа намалување на областа под кривата (AUC) на лизиноприл за 15%, максималната концентрација на плазма (Cmax) на лизиноприл е намалена за 27%. Просечното време за постигнување на максималната концентрација (tmax) на лизиноприл во плазмата при земање лираглутид се зголеми од шест на осум часа. Врз основа на резултатите, не е потребно прилагодување на дозата на лизиноприл и дигоксин при земање на лираглутид.
Максималната концентрација на плазма (Cmax) на етинил естрадиол и левоноргестрел во единечни дози за време на терапијата со лираглутид се намали за 12% и 13%, соодветно. Во истите услови, просечното време за достигнување на концентрацијата на врв (tmax) на овие лекови беше 1,5 часа подоцна од вообичаеното. Клинички значаен ефект врз целокупниот ефект на етинил естрадиол и левоноргестрел во организмот нема лираглутид. Така, очекуваниот контрацептивен ефект на двата лека за време на терапијата со лираглутид не се менува.
Не е откриена фармакокинетичка или фармакодинамичка интеракција на лираглутид со инсулин демимир со единечна употреба на инсулин демимир во доза од 0,5 У / кг со лираглутид во доза од 1,8 мг кај пациенти со дијабетес мелитус тип 2.
Супстанциите додадени на Виктоза® може да предизвикаат деградација на лираглутид. Бидејќи не се спроведени тестови за компатибилност, Виктоза® не може да се меша со други лекови, вклучително и раствори за инфузија.
Специјални упатства
Виктоза® не треба да се користи кај пациенти со дијабетес мелитус тип 1 или за третман на дијабетична кетоацидоза.
Виктозаќ не го заменува инсулинот.
Искуството со употреба на Виктоза® кај пациенти со срцева слабост од функционални класи I-II во согласност со Функционалната класификација на хронична срцева слабост (CHF) на Associationујоршката кардиологија асоцијација (NYHA) е ограничено и затоа лираглутид треба да се користи со претпазливост. Нема искуство во лекување на пациенти со конгестивна срцева слабост од класа III - IV според класификација на NYHA и затоа не се препорачува назначување на лираглутид кај такви пациенти.
Податоците за употреба на лекот Виктоза® кај пациенти со воспалително заболување на цревата и дијабетична пареза на желудникот се ограничени, употребата на лекот Виктоза® во овие групи на пациенти не се препорачува. Употребата на лекот Viktoza® е поврзана со развој на краткорочни несакани реакции од гастроинтестиналниот тракт, како што се гадење, повраќање и дијареја.
Употребата на други агонисти GLP-1 е поврзана со ризик од развој на панкреатитис. Пријавени се неколку случаи на акутен панкреатит. Пациентите треба да бидат информирани за карактеристичните симптоми на развој на акутен панкреатит: постојана силна болка во абдоменот. Ако се сомневаме во панкреатитис, терапијата со Виктоза® и други потенцијално опасни лекови треба веднаш да се запре.
При потврдување на дијагнозата на акутен панкреатитис, употребата на лекот Виктоза® не треба да се продолжи. Потребна е претпазливост при препишување на лекот на пациенти со историја на панкреатитис.
Болест на тироидната жлезда
За време на клиничките испитувања на лекот Виктоза, биле пријавени несакани ефекти на тироидната жлезда, вклучително покачен серум калцитонин, дифузен тиротоксичен гушавост и неоплазми на тироидната жлезда, затоа лираглутид треба да се користи со претпазливост, особено кај пациенти со претходно постоечки заболувања тироидната жлезда (види дел "Несакани ефекти").
Пациентите кои земаат лираглутид во комбинација со сулфонилуреа или базален инсулин може да имаат зголемен ризик од хипогликемија (види дел „Несакани ефекти“). Ризикот од хипогликемија може да се намали со намалување на дозата на сулфонилуреа или базален инсулин.
Знаци и симптоми на дехидрација, вклучително и нарушена бубрежна функција и акутна бубрежна инсуфициенција, се опишани кај пациенти кои земаат лираглутид. Пациентите кои земаат лираглутид треба да бидат советувани за можниот ризик од дехидрација во зависност од несакани ефекти од гастроинтестиналниот тракт и препорачуваат да се преземат мерки на претпазливост за да се спречи осиромашување на течностите во организмот.
Пкклинички податоци за студија за безбедност
Резултатите од претклиничките студии, засновани врз општо прифатените студии за фармаколошка безбедност, токсичност со повторени дози на лекот и генотоксичност, покажаа дека употребата на лираглутид не претставува закана за здравјето на луѓето.
Неоплазми на тироидната жлезда Ц-клетки на глувци и глувци биле откриени за време на двегодишни испитувања за онкогеноста на лекот кај глодари и не довеле до смрт. Ниту еден доказ за несакани ефекти (NOAEL) не е забележан кај стаорци. Појавување на такви неоплазми кај мајмуни третирани со лираглутид 20 месеци не беше забележано. Резултатите добиени во тестовите на глодари се поврзани со фактот дека глодарите се особено чувствителни на рецепторот со посредство на глукагон-пептид -1 (GLP-1) на не-генотоксичен специфичен механизам. Релевантноста на добиените податоци за луѓето е мала, но не може целосно да се исклучи. Појавата на какви било други неоплазми поврзани со терапијата не беше забележана.
Во студиите за животни, немаше директен негативен ефект на лекот врз плодноста, но имаше мало зголемување на фреквенцијата на рана ембрионска смрт за време на третманот со најголема доза на лекот. Воведувањето на лекот Виктоза кај стаорци во средина на гестацискиот период ги натерало да ја намалат телесната тежина на мајката и растот на ембрионот со ефектот што не е целосно разбран врз ребрата и отстапувањата во скелетната структура во групата зајаци. Растот на новороденчиња во групата стаорци за време на терапијата со Виктоза се намали, а ова намалување упорно остана во периодот по доењето кај групата модели кои примаат високи дози на лираглутид. Не е познато што предизвикало такво намалување на растот на новородените стаорци - намалување на нивната потрошувачка на мајчино млеко како резултат на директно влијание на пептид ГЛП-1 сличен на глукагон или недоволно производство на мајчино млеко од мајчински стаорци како резултат на намалување на внесувањето на калории.
По интраметарска инјекција на лираглутид кај зајаци, забележано е благо до умерено крварење, црвенило и оток на местото на инјектирање.
Употреба за време на бременоста и за време на доењето
Студиите за животни не откриле директен несакан ефект на лекот врз плодноста, но има мало зголемување на зачестеноста на раната ембрионска смрт за време на третманот со најголема доза на лекот. Администрацијата на Виктозаќ на стаорци во средината на бременоста предизвика намалување на телесната тежина на мајката и растот на ембрионот со нецелосно проучен ефект врз ребрата и отстапувања во структурата на скелетот во групата зајаци. Растот на новороденчиња кај групите на стаорци за време на терапијата со Виктоза® се намалил, а ова намалување упорно опстојувало по доењето кај групата лица кои примале високи дози на лираглутид. Не е познато што предизвикало такво намалување на растот на новородените стаорци - намалување на потрошувачката на млеко на нивната мајка како резултат на директно влијание на GLP-1, или недоволно ниво на производство на мајчино млеко од страна на стаорци кај мајчињата како резултат на намалување на внесот на калории.
Не се достапни соодветни податоци за употреба на лекот Виктоза® кај бремени жени. Потенцијалниот ризик за луѓето е непознат.
Лекот Viktoza® не може да се користи за време на бременоста, наместо тоа, се препорачува да се спроведе третман со инсулин. Ако пациентот се подготвува за бременост или бременоста веќе започна, терапијата со Виктоза® треба веднаш да се запре.
Нема искуство со употреба на дрога Victoza® кај доилки, употребата на лекот за време на доењето е контраиндицирана.
Карактеристики на ефектот на лекот врз можноста за управување со возила и потенцијално опасни механизми
Не е спроведена студија за ефектот на лекот Виктоза® за можноста за управување со возила и работа со механизми. Пациентите треба да бидат предупредени дека треба да преземат мерки на претпазливост со цел да се избегне развој на состојба на хипогликемија за време на возењето и кога работат со механизми, особено ако Виктоза® се зема како дел од комбинирана терапија со сулфонилуреа или со базален инсулин.
Предозирање
Симптоми: за време на клиничко испитување на Виктоза, еден од пациентите со дијабетес тип 2 претрпел преголема доза на лекот во форма на поткожна инјекција во доза од 72 мг (40 пати поголема од максималната препорачана доза од 1,8 мг). Предозирањето предизвика сериозна гадење и повраќање. Не е забележана хипогликемија. Пациентот се опорави целосно без компликации.
Третман: се препорачува соодветна симптоматска терапија, во зависност од клиничките знаци и симптоми.
Фармакодинамика
Лираглутид е аналог на хуманиот GLP-1 (пекарид-сличен на глукагон). Произведено со методот на биотехнологија на рекомбинантна ДНК (деоксирибонуклеинска киселина) со употреба на видот Saccharomyces cerevisiae, кој има 97% хомологија со човечки GLP-1, ги врзува и активира GLP-1 рецепторите кај луѓето.
GLP-1 рецепторот е мета за роден GLP-1, кој е ендоген хормон на инкретин, кој ја стимулира секрецијата на инсулин зависен од гликоза во б-клетките на панкреасот. Споредено со мајчин GLP-1, фармакодинамските и фармакокинетичките профили на лираглутид овозможуваат да се администрира еднаш дневно.
Со поткожна инјекција, долготрајниот профил на супстанцијата се заснова на три механизми:
- само-здружување, кое обезбедува одложена апсорпција на лираглутид,
- врзувачки за албумин,
- повисоко ниво на ензимска стабилност против DPP-4 (дипептидил пептидаза-4) и NEP (ензимска неутрална ендопептидаза), што обезбедува долг Т1/2 (полуживот) на супстанција од плазма.
Ефектот на лираглутид се заснова на интеракција со специфични GLP-1 рецептори, како резултат на што се зголемува нивото на cAMP (цикличен аденозин монофосфат). Под дејство на супстанцијата, се забележува стимулација на секреција на инсулин зависна од гликоза и се подобрува функцијата на β-клетките на панкреасот. Во исто време, се јавува сузбивање зависно од гликоза на прекумерно зголемено лачење на глукагон. Така, со зголемување на концентрацијата на глукоза во крвта, секрецијата на глукагон е потисната и се стимулира секрецијата на инсулин.
Од друга страна, кај пациенти со хипогликемија, лираглутид го намалува секрецијата на инсулин без да се инхибира секреција на глукагон. Механизмот за намалување на гликемијата исто така вклучува мало одложување на празнењето на желудникот. Користејќи механизми кои предизвикуваат намалување на гладот и намалување на потрошувачката на енергија, лираглутид доведува до намалување на масното ткиво и губење на тежината.
GLP-1 е физиолошки регулатор на апетит и калории, рецепторите на овој пептид се наоѓаат во неколку области на мозокот кои се вклучени во регулирањето на апетитот.
При спроведување на студии за животни, откриено е дека преку специфично активирање на рецепторите GLP-1, лираглутид ги зајакнува сигналите на заситеност и ги ослабува сигналите на глад, а со тоа доведува до губење на тежината.
Исто така, според студиите за животни, лираглутид го забавува развојот на дијабетес. Супстанцијата е моќен фактор во специфичната стимулација на размножување на панкреасните β-клетки и спречува смрт на б-клетки (апоптоза), што е предизвикано од цитокини и слободни масни киселини. Така, лираглутид ја зголемува биосинтезата на инсулин и ја зголемува масата на б-клетките. По нормализирање на концентрацијата на глукоза, лираглутид престанува да ја зголемува масата на панкреасните β-клетки.
Победа има долг 24-часовен ефект и ја подобрува гликемиската контрола, што се постигнува со намалување на концентрацијата на глукоза во постот што постепено и после јадење со дијабетес тип 2.
Фармаколошка група
Други хипогликемични лекови, со исклучок на инсулин.
Код АТЦ A10V X07.
Victoza® се користи за лекување на дијабетес мелитус тип II кај возрасни со цел да се постигне гликемиска контрола во комбинација со:
- метформин или сулфонилуреа кај пациенти со слаба гликемиска контрола, и покрај употребата на максимално толерирани дози на метформин или сулфонилуреа како монотерапија,
- метформин и сулфонилуреа, или метформин и тиазолидионион кај пациенти со слаба гликемиска контрола и покрај двојната терапија.
Комбинирана терапија со базален инсулин кај пациенти кои не постигнале соодветна гликемиска контрола со помош на Виктоза и метформин.
Несакани реакции
Во пет големи, долгорочни клинички испитувања, повеќе од 2500 пациенти примале само Виктоза® или негова комбинација со метформин, со глимепирид (со или без метформин), сулфонилуреа (со или без метформин), или со метформин + росиглитазон.
Проценката на инциденцата на несакани ефекти се спроведуваше на следнава скала: многу често
(≥ 1/10), честопати (од 1/100 до ® - 2501). Презентирани се следните несакани реакции, инциденцата на која кај групата пациенти кои примале лек Виктоза® ја надминале над 5% од фреквенцијата во групата каде што го примиле лекот за споредување. Вклучени се и несакани реакции, чија инциденца е ³1%, но тие се јавуваат повеќе од 2 пати почесто во споредба со лекот за споредување.
Метаболички и хранливи нарушувања: често - хипогликемија, анорексија, ретко се намалува апетит - дехидрација *.
Нарушувања на нервниот систем: често - главоболка, вртоглавица.
Дигестивни нарушувања: многу често - гадење, дијареја, често - повраќање, диспепсија, болка во горниот дел на стомакот, запек, гастритис, надуеност, надуеност, гастроезофагеална рефлуксна болест, belching, забоболка, вирусен гастроентеритис многу ретко - (панкреатитис (вклучувајќи некротичен панкреатитис).
Кардиоваскуларни нарушувања: често - зголемена срцева фреквенција (HR).
Нарушувања на имунолошкиот систем: ретко анафилактички реакции.
Инфекции и инфекции: често - инфекции на горниот респираторен тракт (назофарингитис, бронхитис).
Општи нарушувања и состојба на местото на инјектирање: ретко - малаксаност, често - замор, треска, реакции на местото на инјектирање.
Нарушувања на бубрезите и уринарниот тракт : ретко - акутна бубрежна инсуфициенција *, нарушена бубрежна функција *.
На дел од кожата и поткожното ткиво : често - осип, ретко - уртикарија, чешање.
(* Погледнете го делот Карактеристики на апликацијата).
Опис на индивидуалните несакани реакции
За време на клиничкото испитување на монотерапија со монотерапија Viktoza®, инциденцата на хипогликемија кај пациенти кои земале Виктоза® била помала отколку кај пациенти кои примале активен референтен лек (глимепирид). Најчестите несакани реакции беа гастроинтестинални тегоби, инфекции и наезда.
Во повеќето случаи забележани за време на клиничките испитувања, потврдена хипогликемија е занемарлива. За време на монотерапија со Виктозаиќ, немаше ниту еден случај на тешка хипогликемија. Тешка хипогликемија се јавува ретко и главно се забележува со комбиниран третман со Viktoza® и сулфонилуреа (0,02 случаи / пациенти-години). Многу ретко (0,001 случаи / пациенти-години) имало случаи на хипогликемија за време на третманот со Виктоза® во комбинација со други орални антидијабетични лекови (т.е. не со сулфонилуреја).
По дополнителната администрација на инсулин за да ги детектираат пациентите, тие добиле лираглутид од 1,8 мг метформин, немало случаи на тешка хипогликемија. Инциденцата на лесна хипогликемија била 0,286 случаи на пациент-година. Во групите за споредба, инциденцата на лесна хипогликемија била 0,029 случаи на пациент-годишно во третманот со лираглутид
1,8 mg и 0,129 случаи на пациент-година со третман со метформин.
Дигестивни нарушувања
Повеќето случаи на гадење биле благи или умерени, привремени и ретко доведувале до повлекување на терапијата.
Со комбиниран третман со Victoza® и metformin, гадење се појави најмалку еднаш на 20,7% од пациентите и дијареја кај 12,6% од пациентите. Кога се комбинира со Виктотош и сулфонилуреа, гадење се појави најмалку еднаш во 9,1% од пациентите, а дијареја кај 7,9%. Повеќето случаи биле со блага или умерена тежина и зависат од дозата.
Кај пациенти постари од 70 години, нарушувања на дигестивниот систем може да се појават со третман со Виктоза.
Кај пациенти со слабо нарушена бубрежна функција (клиренс на креатинин од 60-90 ml / мин), нарушувања на дигестивниот систем може да се појават почесто со третман со Виктоза®.
Повлекување на лекови
За време на долгорочни контролирани испитувања (26 недели или подолго), фреквенцијата на повлекување на лекот Виктозаќ како резултат на несакани реакции се појави на 7,8%, а повлекувањето на споредбениот лек беше 3,4%. Најчеста причина за ова кај пациенти кои примаат Виктоза® беше гадење (2,8%) и повраќање (1,5%).
Поради потенцијалните имуногени својства на лековите кои содржат протеини или пептиди, анти-лираглутидните антитела можат да се формираат кај пациенти третирани со Виктоза. Пронајдени се во просек од 8,6% од пациентите. Формирањето на антитела не беше поврзано со намалување на ефективноста на Виктоза®.
Реакции на страницата за инјектирање
За време на долгорочни контролирани испитувања (26 недели или подолго), реакциите на местото на инјектирање на Виктоза® се пријавени кај приближно 2% од пациентите. Овие реакции беа обично благи.
Во текот на долги клинички испитувања, неколку случаи биле пријавени за време на третманот со Виктозаќ (® ниту бил утврден ниту исклучен).
Дисфункција на тироидната жлезда
Вкупната зачестеност на дисфункција на тироидната жлезда во текот на сите студии (средно и долго траење) беше 33,5, 30,0 и 21,7 случаи на 1000 пациенти-години на вкупно изложување на лираглутиди, плацебо и лекови за споредување, со 5,4 , 2,1 и 0,8 случаи, соодветно, се припишувале на сериозни несакани реакции.
Кај пациенти третирани со Виктоза, најчесто се забележани тумори на тироидната жлезда, зголемено ниво на калцитонин во крвта и гушавост.
По започнувањето на Виктозаж на пазарот, се пријавени алергиски реакции, вклучително и уртикарија, осип и пруритус. Пријавени се и неколку случаи на анафилактички реакции со дополнителни симптоми како што се хипотензија, палпитации, диспнеа и едем.
Употреба за време на бременост и лактација
Не се достапни соодветни податоци за употреба на лекот Виктоза® од бремени жени. Студиите за животни покажаа репродуктивна токсичност (види дел „Предклинички податоци за безбедност“). Потенцијалниот ризик за луѓето е непознат.
Лекот Виктоза® не треба да се користи за време на бременоста, се препорачува наместо тоа да се препише инсулин. Ако пациентот сака да забремени или бремена, тогаш лекот Виктоза треба да се прекине.
Период на лактација
Не е познато дали лираглутид се излачува во мајчиното млеко. Студиите за животни покажаа дека незначителни количини на лираглутиди и неговите тесно поврзани структурни метаболити се впуштаат во млеко. Поради недоволно искуство за време на доењето, лекот Виктоза® не треба да се користи.
Поради недостаток на податоци, Виктоза® не се препорачува за деца.
Карактеристики на апликацијата
Victoza® не се користи за лекување на пациенти со дијабетес мелитус тип 1 или дијабетична кетоацидоза.
Виктозаќ не е замена за инсулин.
Ефективноста на дополнителниот внес на лираглутид кај пациенти кои веќе се лекуваат со инсулин, а не се проценува.
Искуството за лекување на пациенти со конгестивна срцева слабост од I-II класи (според класификацијата на Associationујоршката асоцијација за кардиологија - NYHA) е ограничено, и нема податоци за третман на пациенти со конгестивна срцева слабост од класи III-IV.
Поради ограничено искуство, не се препорачува препишување на лекот Виктоза® на пациенти со воспалителни заболувања на цревата и дијабетична гастропареза.
Употребата на други аналози на GLP-1 е поврзана со ризик од развој на панкреатитис. Постојат голем број на извештаи за акутен панкреатитис. Пациентите треба да бидат информирани за карактеристичните симптоми на акутен панкреатитис (постојана, силна болка во абдоминалната празнина). Ако се сомневаме во панкреатитис, третманот со Viktoza® и други провокативни лекови треба да се прекине.
За време на клиничките испитувања, забележаните несакани реакции од тироидната жлезда се зголемување на нивото на калцитонин во крвта, гушавоста и туморот, особено кај пациенти со постојни заболувања на тироидната жлезда (види дел „Несакани реакции“).
Пациентите третирани со Виктоза® доживеале симптоми на дехидрација, вклучувајќи нарушена бубрежна функција и акутна бубрежна инсуфициенција.
Пациентите кои се наменети за Виктоза® треба да бидат предупредени за можноста за дехидрираност како резултат на нарушувања на дигестивниот систем и потребата да се преземат мерки на претпазливост за дехидрација.
Кај пациенти кои примаат лек Виктоза® истовремено со сулфонилуреа, ризикот од развој на хипогликемија е зголемен (види дел „Несакани реакции“). Ризикот од хипогликемија може да се намали со намалување на дозата на сулфонилуреа.
Способност да се влијае на стапката на реакција при возење возила или други механизми
Не се спроведени студии за ефектот на лекот Виктоза® за можноста за управување со возила и други механизми. На пациентите треба да им се советува да преземат мерки за да спречат појава на хипогликемија за време на периодот на возење возило или друг механизам, особено при употреба на лекот Виктотош истовремено со сулфонилуреа.
Интеракција со други лекови и други видови интеракции .
Ин витро лираглутид покажа многу низок потенцијал за фармакокинетика на други активни супстанции, чија размена е поврзана со цитохром 450 како и врзување за плазма протеините.
Лираглутид предизвикува мало одложување на празнењето на желудникот, може да влијае на апсорпцијата на лекови што се користат истовремено внатре.
Лираглутид не ја смени вкупната изложеност на парацетамол после единечна доза од 1000 мг. Максимална концентрација на парацетамол (C макс ) се намали за 31%, а времето да се постигне максимална концентрација (т макс ) се зголеми на 15 минути. Со истовремена употреба на парацетамол, не е потребно прилагодување на дозата.
Аторвастатин Лираглутид не ја смени вкупната изложеност на аторвастатин на клинички значајно ниво по единечна доза од тоа во доза од 40 мг. Во овој поглед, со истовремена употреба на Viktozoy® не е потребно прилагодување на дозата на аторвастатин. Коадминистриран со лираглутид Ц. макс аторвастатин се намали за 38% и t макс се зголеми од 1:00 до 3:00 часот.
Грисеофулвин Лираглутид не ја смени вкупната изложеност на гризофулвин по единечна доза од 500 мг. В макс се зголеми за 37%, додека т макс не се смени. Не е потребно прилагодување на дозата при употреба на гризеофулвин и други соединенија со низок корен со висока пропустливост.
Лисиноприл и дигоксин
По единечно вбризгување од 20 мг лизиноприл или 1 мг дигоксин во комбинација со лираглутид, забележано е намалување на пределот под кривата на време на концентрација-време (АЦЦ) на овие лекови за 15% и 16%, соодветно, додека Ц макс се намали за 27% и 31%, соодветно. Т макс лисиноприл се зголеми од 6:00 до 8:00 часот, додека дигоксинот се зголеми од 1:00 на 1,5 часа. Врз основа на овие резултати, при употреба на лираглутид, прилагодување на дозата на лизиноприл или дигоксин не е потребно.
Со употреба на единечна доза на орални контрацептиви, лираглутид го намали C макс етинил естрадиол или левоноргестрел за 12% и 13%, соодветно, и t макс се зголеми за 1,5 часа. Ова не покажа клинички ефект врз вкупната изложеност на етинил естрадиол или левоноргестрел, што сугерира дека истовремената употреба на лираглутид нема да влијае на контрацептивниот ефект на етинил естрадиол и левоноргестрел.
Варфарин и други деривати на кумарин
Не се извршени студии за интеракција со лекови. На почетокот на третманот со Viktoza® за пациенти кои примаат варфарин или други деривати на кумарин, се препорачува чести мониторинг на INR (Меѓународен нормализиран однос).
Кај пациенти со стабилизиран дијабетес мелитус тип 2 со истовремена администрација на инсулин, Детемир (5 U / кг) и лираглутид (1,8 мг) не покажале знаци на фармакокинетска и фармакодинамичка интеракција.
Фармакокинетика
По субкутана администрација, апсорпцијата на лираглутид е бавна, Тмакс (време да се достигне максимална концентрација) во плазмата е 8-12 часа. Вмакс (максимална концентрација) во плазмата по администрација на единечна доза од 0,6 mg е 9,4 nmol / L. При употреба на доза од 1,8 mg просечно ЦССС (концентрација на рамнотежа) во плазмата достигнува приближно 34 nmol / L. Изложеноста на супстанцијата е подобрена во однос на дозата. Интра-индивидуалниот коефициент на варијација за AUC (областа под кривата на концентрација-време) по администрација на лираглутид во единечна доза е 11%. Апсолутната биорасположивост е околу 55%.
Гледајќи В.г. (волумен на дистрибуција) на лираглутид во ткива со поткожен пат на администрација е 11-17 l, просечна вредност на Vг. по интравенска администрација - 0,07 л / кг. Забележено е значително врзување на лираглутид со плазма протеини (> 98%).
Метаболизмот на лираглутид се јавува како големи протеини, без учество како патека за излачување на некој специфичен орган. За 24 часа по администрација на единечна доза, непроменетата супстанција останува главната компонента на плазмата. Два метаболити се откриени во плазмата (≤ 9 и ≤ 5% од вкупната доза).
Непроменет лираглутид по администрација на доза од 3 Н-лираглутид во урина или измет не е утврден. Само мал дел од метаболитите поврзани со супстанцијата се излачуваат од бубрезите или преку цревата (6 и 5%, соодветно). По субкутана администрација на единечна доза на лираглутид, просечната дозвола од телото е приближно 1,2 л / ч со елиминација Т1/2 околу 13 часа.
Ослободете форма и пакување
3 ml од лекот во кертриџ стакло 1 хидролитичка класа, плутана со диск од бромоутил гума / полиизопрена од едната страна и клип од бромоутил гума од друга страна. Касетата е запечатена во пластично пенкало за еднократна употреба за повеќе инјекции.
2 пластични шприцеви за еднократна употреба за повеќе инјекции заедно со упатства за медицинска употреба во државниот и рускиот јазик се сместени во пакет од картон.
Секое пенкало за шприц (3 ml) содржи 30 дози од 0,6 мг, 15 дози од 1,2 мг или 10 дози од 1,8 мг лираглутид.
Индикации за употреба
Според упатствата, Виктоста се користи за дијабетес тип 2 во комбинација со диета и вежбање за да се постигне гликемиска контрола.
Можни начини на употреба на лекот:
- монотерапија
- комбинирана терапија со еден или повеќе орални хипогликемични агенси (тиазолидиониони, сулфонилуреа, метформин) кај пациенти кои не успеале да постигнат соодветна гликемиска контрола за време на претходната терапија,
- комбинирана терапија со базален инсулин кај пациенти кои не успеале да постигнат соодветна гликемиска контрола користејќи Виктоза во комбинација со метформин.
Упатства за употреба Виктоза: метод и дозирање
Виктоза треба да се администрира субкутано во стомакот, рамото или бутот еднаш дневно, без оглед на оброците. Местото и времето на инјектирање може да се смени без прилагодување на дозата, сепак, пожелно е да се администрира лекот приближно во исто време од денот, што е најзгодно за пациентот.
За да се подобри гастроинтестиналната толеранција, се препорачува третман со дневна доза од 0,6 mg. По минимум една недела, дозата се зголемува на 1,2 mg. Доколку е потребно, за да се постигне најдобра гликемиска контрола, земајќи ја предвид клиничката ефективност на Виктоза, можно е зголемување на дозата до 1,8 мг барем една недела подоцна. Не се препорачува употреба на повисоки дози.
Лекот може да се препише покрај тековната терапија со метформин или комбинирана терапија со метформин во комбинација со тиазолидидион. Дозите на второто не треба да се прилагодат.
Победата може да се додаде на постојната терапија со дериват на сулфонилуреа или комбинирана терапија со метформин во комбинација со деривати на сулфонилуреа. Во овој случај, за да се минимизира ризикот од развој на несакана хипогликемија, дозата на деривати на сулфонилуреа треба да се намали.
Виктоза може да се додаде и на базалниот инсулин, но за да се намали ризикот од хипогликемија, потребно е да се намали дозата на инсулин.
Во случај на недостаток на дозата:
- ако не поминале повеќе од 12 часа, мора да ја внесете пропуштената доза што е можно поскоро,
- ако поминале повеќе од 12 часа, следната доза мора да се администрира следниот ден во предвиденото време, т.е., не е неопходно да се компензира пропуштената доза со воведување дополнителна или двојна доза.
Упатство за употреба на лекот
Секое пенкало за шприц е дизајнирано за индивидуална употреба.
Лекот треба да се администрира со употреба на игли до 8 mm долги и до 32G дебели (не се вклучени, затоа се купуваат одделно). Пенкаловите со шприц се комбинираат со игли за еднократна употреба за инјектирање НовоТвист и НовоФајн.
Виктоза не треба да се администрира ако решението изгледа различно од чиста, скоро безбојна или безбојна течност.
Вие не можете да го внесете лекот ако претрпел замрзнување.
Не чувајте го пенкалото за шприц со закачена игла. После секоја инјекција, мора да се исфрли. Оваа мерка спречува истекување, загадување и инфекција на лекот, а исто така гарантира точност на дозирање.
Услови за складирање
Да се чува на 2 ° C до 8 ° C (во фрижидер). Не замрзнувајте.
За пенкало за шприц во употреба: користете во рок од 1 месец. Чувајте ја на температура не поголема од 30 ° C или од 2 ºC до 8 ºC (во фрижидер). Не замрзнувајте. Не чувајте ја со приложената игла. Покријте го пенкалото за шприц со капа за да го заштитите од светлина.
Да се чува подалеку од дофатот на децата!
Упатство за употреба и отстранување
Victoza® не може да се користи ако изгледа различно од чиста и безбојна или речиси безбојна течност.
Виктоза® не може да се користи ако е замрзнат.
Victoza® може да се администрира со помош на игли до 8 mm долги и до 32G дебели. Пенкалото за шприц е наменето за употреба во комбинација со игли за еднократна употреба инекција NovoFayn® или NovoTvist®.
Иглите за инјектирање не се вклучени во пакетот.
Пациентот треба да биде информиран дека употребената игла треба да се исфрли после секоја инјекција и исто така дека пенкалото-шприц со приложената игла не може да се чува. Ваквата мерка ќе спречи загадување, инфекција и истекување на лекот од пенкалото за шприц и ќе гарантира точно дозирање.